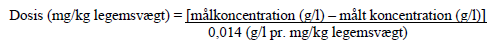Fibryga®
pulver og solvens til injektions- /infusionsvæske, opløsning 1 g
Octapharma
Om indlægssedlen
Indlægsseddel: Information til brugeren
Fibryga 1 g pulver og solvens til injektions-/infusionsvæske, opløsning
humant fibrinogen
Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
- Gem indlægssedlen. Du kan få brug for at læse den igen.
- Spørg lægen eller apotekspersonalet, hvis der er mere, du vil vide.
- Lægen har ordineret dette lægemiddel til dig personligt. Lad derfor være med at give lægemidlet til andre. Det kan være skadeligt for andre, selvom de har de samme symptomer, som du har.
- Kontakt lægen eller apotekspersonalet, hvis du får bivirkninger, herunder bivirkninger, som ikke er nævnt i denne indlægsseddel. Se punkt 4.
Se den nyeste indlægsseddel på www.indlaegsseddel.dk
Oversigt over indlægssedlen
- Virkning og anvendelse
- Det skal du vide, før du begynder at bruge Fibryga
- Sådan skal du bruge Fibryga
- Bivirkninger
- Opbevaring
- Pakningsstørrelser og yderligere oplysninger
1. Virkning og anvendelse
Virkning
Fibryga indeholder humant fibrinogen, som er et protein, der har betydning for blodets evne til at størkne (koagulere). Hvis man mangler fibrinogen, kan blodet ikke størkne, som det skal, og det giver øget blødningstendens. Fibryga erstatter det manglende fibrinogen og genopretter dermed blodstørkningsevnen.
Anvendelse
Fibryga anvendes til:
- behandling af blødningsepisoder og som profylakse til operation hos patienter, der har øget blødningstendens på grund af medfødt mangel på fibrinogen (hypofibrinogenæmi eller afibrinogenæmi).
- fibrinogensupplering hos patienter med ukontrolleret alvorlig blødning ledsaget af erhvervet mangel på fibrinogen under operation.
2. Det skal du vide, før du begynder at bruge Fibryga
Lægen kan have foreskrevet anden anvendelse eller dosering end angivet i denne information. Følg altid lægens anvisning og oplysningerne på doseringsetiketten.
Brug ikke Fibryga:
- hvis du er allergisk over for humant fibrinogen eller et af de øvrige indholdsstoffer i Fibryga (angivet i punkt 6).
- hvis du tidligere har haft en allergisk reaktion over for Fibryga.
Sig det til lægen, hvis du er allergisk over for et eller flere lægemidler.
Advarsler og forsigtighedsregler
Kontakt lægen eller apotekspersonalet, før du bruger Fibryga.
Risiko for blodpropper i blodårerne
Lægen skal vurdere fordelene ved dette lægemiddel i forhold til risikoen for blodpropper i blodårerne, navnlig:
- hvis der er tale om høje eller gentagne doser af lægemidlet
- hvis du har haft et hjerteanfald (tidligere tilfælde af sygdom i kranspulsårerne eller blodprop i hjertet)
- hvis du har en leversygdom
- hvis du lige er blevet opereret
- hvis du snart skal opereres
- hvis der er tale om et nyfødt barn
- hvis du har en større risiko for at få blodpropper end normalt (patienter i risikogruppen for tromboemboliske komplikationer eller dissemineret intravaskulær koagulation)
Lægen vil muligvis foretage supplerende blodstørkningstest for at overvåge risikoen.
Allergiske eller anafylaktiske reaktioner
Alle lægemidler, herunder Fibryga, der er fremstillet af menneskeblod (med proteiner), og som sprøjtes ind i en blodåre (intravenøst), kan give allergiske reaktioner. Hvis du tidligere har haft allergiske reaktioner på Fibryga, vil lægen fortælle dig, om du skal have allergimedicin.
Lægen vil forklare dig, hvad advarselstegnene på allergiske eller anafylaktiske reaktioner er.
Du skal være opmærksom på tidlige tegn på allergiske reaktioner (overfølsomhed), f.eks.:
- nældefeber
- hududslæt
- trykken for brystet
- hvæsende vejrtrækning
- lavt blodtryk
- anafylaksi, dvs. hvis et eller flere af ovenstående symptomer udvikles hurtigt og voldsomt.
Hvis disse symptomer opstår, skal injektionen/infusionen af Fibryga standses med det samme.
Virussikkerhed
Når man fremstiller lægemidler af blod eller plasma fra mennesker, gælder der visse forholdsregler for at undgå overførsel af infektioner til patienterne. Disse forholdsregler omfatter:
- omhyggelig udvælgelse af blod- og plasmadonorer, så man kan udelukke potentielle smittebærere
- undersøgelse af hver donation og plasmaportion for tegn på virus/infektioner
- fremstillingen af blodet eller plasmaet omfatter procestrin, der kan deaktivere eller fjerne vira.
Til trods for disse forholdsregler kan muligheden for infektion ikke helt udelukkes ved behandling med lægemidler, der er fremstillet af blod eller plasma. Dette gælder også ukendte eller helt nye vira eller andre former for infektioner.
Forholdsreglerne vurderes at være effektive over for såkaldt kappebærende vira som f.eks. hiv, hepatitis B-virus og hepatitis C-virus samt over for det ikke-kappebærende hepatitis A-virus. Forholdsreglerne kan være af begrænset værdi for ikke-kappebærende vira som f.eks. parvovirus B19.
Parvovirus B19-infektion kan være alvorlig for gravide kvinder (det ufødte barn kan blive smittet) og for personer med nedsat immunforsvar eller visse former for blodmangel (f.eks. seglcelleanæmi (hvor der sker unormal nedbrydning af røde blodlegemer)).
Det anbefales på det kraftigste, at produktets navn og batchnummer noteres, hver gang du får en dosis Fibryga, for at bevare overblikket over de anvendte batcher.
Lægen vil muligvis anbefale dig at blive vaccineret mod hepatitis A og B, hvis du regelmæssigt/gentagne gange skal have fibrinogenholdige lægemidler, der er fremstillet af plasma fra mennesker.
Børn og unge
Der gælder ingen særlige eller supplerende advarsler og forsigtighedsregler for børn og unge.
Brug af andre lægemidler sammen Fibryga
Fortæl det altid til lægen eller apotekspersonalet, hvis du tager andre lægemidler, for nylig har taget andre lægemidler eller planlægger at tage andre lægemidler.
Fibryga må ikke blandes med andre lægemidler, bortset fra de lægemidler, der er nævnt i afsnittet
"Nedenstående oplysninger er til læger og sundhedspersonale".
Graviditet, amning og frugtbarhed
Hvis du er gravid eller ammer, har mistanke om, at du er gravid, eller planlægger at blive gravid, skal du spørge din læge eller apotekspersonalet til råds, før du bruger dette lægemiddel. Du må kun bruge dette lægemiddel under graviditet eller amning efter at have rådført dig med din læge eller apotekspersonalet.
Trafik- og arbejdssikkerhed
Fibryga påvirker ikke evnen til at føre motorkøretøj eller betjene maskiner.
Fibryga indeholder natrium
Dette lægemiddel indeholder op til 132 mg natrium (hoved komponent af madlavnings-/bordsalt) pr. flaske. Dette svarer til 6,6 % af den anbefalede maksimale daglige indtagelse af natrium for en voksen. Hvis du er på natrium- eller saltfattig diæt, skal du tage hensyn hertil.
3. Sådan skal du bruge Fibryga
Brug altid lægemidlet nøjagtigt efter lægens anvisning. Er du i tvivl, så spørg lægen.
Fibryga indgives gennem et drop i en blodåre (intravenøs infusion) af sundhedspersonale.
Dosis og doseringsplanen afhænger af:
- din vægt
- sværhedsgraden af din sygdom
- blødningssted eller
- operationstype og
- din helbredstilstand.
Brug til børn og unge
Fibryga indgives til børn og unge på samme måde som til voksne (gennem et drop i en blodåre).
Hvis du har fået for meget Fibryga
Kontakt lægen, skadestuen eller apotekspersonalet, hvis du har fået mere af Fibryga, end der står i denne indlægsseddel, eller mere end lægen har foreskrevet (og du føler dig utilpas).
For at undgå overdosering vil lægen tage regelmæssige blodprøver til måling af din fibrinogenkoncentration.
Ved overdosering kan der være øget risiko for unormal blodstørkning i blodårerne.
Spørg lægen eller apotekspersonalet, hvis der er noget, du er i tvivl om.
Indgivelsesmåde
Dette lægemiddel skal indgives i en blodåre ved injektion (indsprøjtning) eller infusion (gennem et drop) efter rekonstitution med den medfølgende solvens. Spørg lægen eller apotekspersonalet, hvis der er noget, du er i tvivl om.
4. Bivirkninger
Dette lægemiddel kan som alle andre lægemidler give bivirkninger, men ikke alle får bivirkninger.
Kontakt lægen med det samme:
- hvis du får en eller flere af de anførte bivirkninger
- hvis du får en bivirkning, der ikke er nævnt i denne indlægsseddel.
Ved brug af Fibryga og andre fibrinogenholdige lægemidler er der rapporteret om følgende bivirkninger (med hyppigheden "ikke kendt"):
- Allergiske eller anafylaktiske reaktioner/hudreaktioner såsom udslæt eller rødmen af huden (se punkt 2 under "Advarsler og forsigtighedsregler")
- Hjerte-kar-systemet: Betændelse i blodårer og dannelse af blodpropper (se punkt 2 under "Advarsler og forsigtighedsregler")
- Stigning i kropstemperatur.
Hvis du får et eller flere af de nævnte symptomer, skal du kontakte lægen så hurtigt som muligt.
Indberetning af bivirkninger
Hvis du oplever bivirkninger, bør du tale med din læge eller apotekspersonalet. Dette gælder også mulige bivirkninger, som ikke er medtaget i denne indlægsseddel. Du eller dine pårørende kan også indberette bivirkninger direkte til Lægemiddelstyrelsen via:
Lægemiddelstyrelsen
Axel Heides Gade 1
DK-2300 København S
Websted: www.meldenbivirkning.dk
Ved at indrapportere bivirkninger kan du hjælpe med at fremskaffe mere information om sikkerheden af dette lægemiddel.
5. Opbevaring
Opbevar lægemidlet utilgængeligt for børn.
Brug ikke lægemidlet efter den udløbsdato, der står på pakningen efter EXP. Udløbsdatoen er den sidste dag i den nævnte måned.
Må ikke opbevares ved temperaturer over 25 C. Må ikke nedfryses. Opbevar flasken i den ydre karton for at beskytte mod lys.
Pulveret må først opløses umiddelbart før injektion/infusion. Der er påvist kemisk og fysisk brugsstabilitet for den rekonstituerede opløsning i 24 timer ved stuetemperatur (maks. 25 °C), men for at undgå forurening bør opløsningen anvendes med det samme og kun én gang. Det rekonstituerede produkt må ikke opbevares i køleskab eller nedfryses.
Spørg apotekspersonalet, hvordan du skal bortskaffe lægemiddelrester. Af hensyn til miljøet må du ikke smide lægemiddelrester i afløbet, toilettet eller skraldespanden.
6. Pakningsstørrelser og yderligere oplysninger
Fibryga indeholder:
- Aktivt stof: humant fibrinogen.
- Fibryga indeholder 1 g humant fibrinogen pr. flaske eller 20 mg/ml humant fibrinogen efter rekonstitution med den medfølgende solvens (50 ml vand til injektionsvæsker).
- Øvrige indholdsstoffer: L-argininhydrochlorid, glycin, natriumchlorid og natriumcitratdihydrat.
Udseende og pakningsstørrelser
Fibryga leveres som et pulver med solvens til injektions-/infusionsvæske, opløsning, og fås i glasflasker.
Pulveret er hvidt eller bleggult samt vandsugende og fremstår også som en porøs fast masse.
Solvensen er en klar, farveløs væske.
Den rekonstituerede opløsning er næsten farveløs og let opaliserende.
Fibryga fås i en karton, der indeholder:
- 1 flaske med pulver til injektions-/infusionsvæske, opløsning
- 1 hætteglas med solvens (vand til injektionsvæsker)
- 1 nextaro-overførselssæt
Indehaver af markedsføringstilladelsen og fremstiller
Indehaver af markedsføringstilladelsen
Octapharma AB
Lars Forssells gata 23
S-112 75 Stockholm
Sverige
Repræsentant
Octapharma Pharmazeutika Produktionsges.m.b.H
Oberlaaer Str. 235
1100 Vienna
Østrig
Fremstillere
Octapharma Pharmazeutika Produktionsges.m.b.H.
Oberlaaer Strasse 235, 1100 Wien, Østrig
Octapharma AB
Lars Forssells gata 23, S-112 75 Stockholm, Sverige
Dette lægemiddel er godkendt i EEAs medlemslande og i Det Forenede Kongerige (Nordirland) under følgende navne:
Fibryga®: Belgien, Bulgarien, Cypern, Danmark, Den Tjekkiske Republik, Det Forenede Kongerige (Nordirland), Estland, Finland, Frankrig, Holland, Irland, Island, Italien, Kroatien, Letland, Litauen, Luxembourg, Malta, Norge, Polen, Portugal, Rumænien, Slovakiet, Spanien, Sverige, Tyskland, Ungarn, Østrig
Fibrema®: Slovenien
Oplysniner tiltænkt læger og sundhedspersonale
Nedenstående oplysninger er til læger og sundhedspersonale:
Dosering
Dosis og varighed af substitutionsterapien afhænger af sygdommens sværhedsgrad, blødningens lokalisering og omfang samt af patientens kliniske tilstand.
Den (funktionelle) fibrinogenkoncentration skal fastslås for at beregne den individuelle dosering, og mængden og administrationshyppigheden skal bestemmes individuelt fra patient til patient ved regelmæssig måling af fibrinogenkoncentrationen i plasma og kontinuerlig overvågning af patientens kliniske tilstand samt under hensyn til eventuelle andre anvendte substitutionsterapier.
Ved større kirurgiske indgreb er det meget vigtigt at overvåge substitutionsterapien nøje ved hjælp af koagulationsanalyse.
1. Profylakse hos patienter med medfødt hypo- eller afibrinogenæmi og kendt blødningstendens.
For at undgå kraftig blødning under kirurgiske indgreb anbefales det at behandle profylaktisk (forebyggende) og øge fibrinogenkoncentrationen til 1 g/l og opretholde denne fibrinogenkoncentration, indtil der er sikret hæmostase, og holde det på over 0,5 g/l, indtil der er sket fuldstændig sårheling.
Ved kirurgiske indgreb eller behandling af blødningsepisoder skal dosis beregnes som følger:

Efterfølgende dosering (doser og injektionshyppighed) skal justeres ud fra patientens kliniske status og laboratorieresultater.
Den biologiske halveringstid for fibrinogen er 3-4 dage. Ved manglende udnyttelse er gentagen behandling med humant fibrinogen derfor normalt ikke påkrævet. I betragtning af den akkumulering, der ses ved gentagen administration i forbindelse med profylakse (forebyggende behandling), skal lægen fastsætte dosis og hyppighed ud fra de terapeutiske mål hos den enkelte patient.
Pædiatriske population
Ved kirurgiske indgreb eller behandling af blødningsepisoder skal dosis hos unge beregnes i henhold til formlen beskrevet for voksne ovenfor, mens dosis hos børn < 12 år skal beregnes som følger:
Efterfølgende dosering skal justeres ud fra patientens kliniske status og laboratorieresultater.
Ældre patienter
Der er ikke gennemført kliniske studier af Fibryga hos patienter i alderen 65 år og derover til entydig dokumentation af, hvorvidt denne patientgruppe responderer på en anden måde end yngre patienter.
2. Behandling af blødning
Blødning hos patienter med medfødt hypo- eller afibrinogenæmi
Blødningsepisoder skal behandles i henhold til formlerne ovenfor for henholdsvis voksne/unge og børn, for at nå en målkoncentration for plasmafibrinogen på 1 g/l. Denne koncentration skal opretholdes, indtil der er sikret hæmostase.
Blødning hos patienter med erhvervet fibrinogenmangel
Voksne
Generelt administreres 1-2 g til at starte med, med efterfølgende infusioner efter behov. I tilfælde af alvorlig blødning, f.eks. ved større kirurgiske indgreb, kan det være nødvendigt med større mængder af fibrinogen (4-8 g).
Pædiatrisk population
Doseringen skal bestemmes iht. kropsvægt og klinisk behov, men er normalt 20-30 mg/kg.
Instruktioner for forberedelse og administration
Generelle instruktioner
- Den rekonstituerede opløsning skal være næsten farveløs og let opaliserende. Hvis opløsningen er uklar eller har bundfald, må den ikke bruges.
- Fibryga er kun til engangsbrug. Ingen af komponenterne må genbruges.
- Af hensyn til mikrobiologisk sikkerhed bør opløsningen administreres umiddelbart efter rekonstitution. Den kemiske og fysiske stabilitet af den rekonstituerede opløsning under brug er blevet påvist i 24 timer ved stuetemperatur (maks. 25° C). Efter rekonstitution må Fibryga opløsningen ikke opbevares i køleskab eller fryses.
Rekonstitution
1. Sørg for, at flasken med pulver (Fibryga) og hætteglasset med solvens har stuetemperatur. Denne temperatur skal opretholdes under rekonstitution. Hvis der anvendes vandbad til opvarmning, skal det sikres, at vand ikke kommer i kontakt med gummipropperne eller beholdernes flip-off-låg. Vandbadets temperatur må ikke overskride +37° C.
2. Fjern flip-off-lågene fra flasken med pulver (Fibryga) og hætteglasset med solvens, så den centrale del af infusionsproppen blotlægges. Rens gummipropperne med en spritserviet, og lad gummipropperne tørre.
3. Åbn pakken med overførselssættet (nextaro) ved at trække låget af (figur 1). For at opretholde sterilitet må du ikke fjerne overførselssættet fra den klare blisterpakning. Rør ikke ved spyddet.
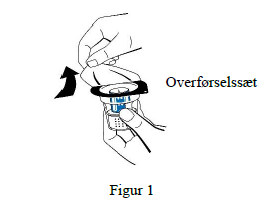
4. Placer hætteglasset med solvens på en jævn, ren overflade og hold godt fast om det. Uden at fjerne blisterpakningen anbringes den blå del af overførselssættet oven på hætteglasset med solvens. Tryk lige ned med et fast tryk, indtil den klikker på plads (figur 2). Må ikke drejes under montering.
Bemærk:
Overførselssættet skal først fastgøres til hætteglasset med solvens og derefter til flasken med frysetørret pulver. Ellers opstår tab af vakuum, og overførslen af solvensen finder ikke sted.
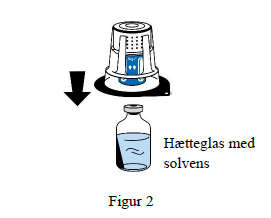
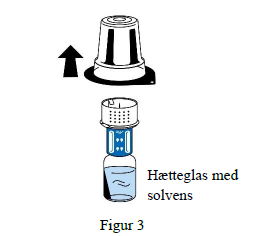
5. Mens der holdes fast i hætteglasset med solvens, fjernes blisterpakningen forsigtigt fra overførselssættet (nextaro) ved at trække lodret opad. Sørg for, at overførselssættet er fast monteret på hætteglasset med solvens (figur 3).
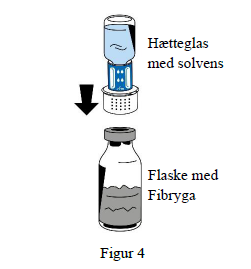
6. Placer flasken med solvens (Fibryga) på en jævn, ren overflade, og hold godt fast om den. Tag hætteglasset med solvens med det påsatte overførselssæt og vend det på hovedet. Placer den hvide del af overførselssættets tilslutning oven på flasken med pulver (Fibryga), og tryk den godt ned, indtil den klikker på plads (figur 4). Må ikke drejes under montering. Solvensen vil automatisk strømme ind i flasken med pulver (Fibryga).
7. Mens hætteglasset med solvens stadig er påsat, hvirvles flasken med Fibryga forsigtigt rundt, indtil pulveret er helt opløst. For at undgå skumdannelse må flasken ikke rystes. Pulveret bør være helt opløst inden for ca. 5 minutter. Det må ikke tage mere end 20 minutter at opløse pulveret. Hvis pulveret ikke er opløst inden for 20 minutter, skal produktet kasseres.
8. I det sjældne tilfælde at det ikke-rekonstituerede pulver observeres flydende under overførslen af vandet til injektionsvæsker eller at rekonstitutionstiden uventet forlænges, kan opløsningsprocessen fremskyndes ved en mere kraftig vandret agitation af hætteglasset.
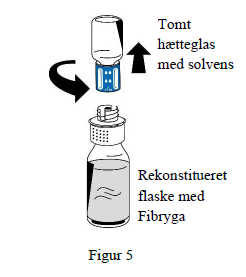
9. Når rekonstitutionen er komplet, skrues overførselssættet (blå del) mod uret i to dele (figur 5). Rør ikke ved Luer lock-tilslutningen på den hvide del af overførselssættet.
10. Kassér det tomme hætteglas med solvens sammen med den blå del af overførselssættet.
Administration
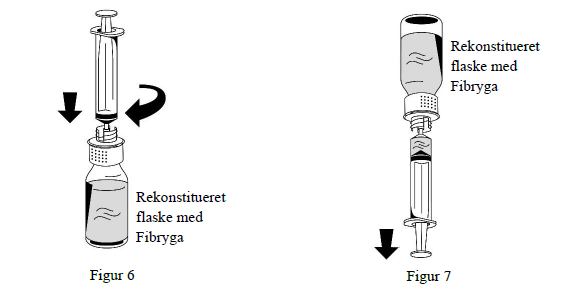
1. Sæt forsigtigt en sprøjte på Luer lock-tilslutningen på den hvide del af overførselssættet (figur 6).
2. Vend Fibryga-flasken på hovedet, og træk opløsningen ind i sprøjten (figur 7).
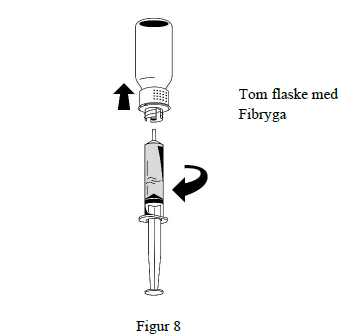
3. Når opløsningen er overført, skal der holdes godt fast i sprøjtens cylinder (med sprøjtestemplet vendende nedad) mens sprøjten fjernes fra overførselssættet (figur 8).
4. Den hvide del af overførselssættet bortskaffes sammen med den tomme Fibryga-flaske.
Det anbefales at bruge et standardinfusionssæt til intravenøs indgivelse af den rekonstituerede opløsning ved stuetemperatur.
Ikke anvendt lægemiddel samt affald heraf skal bortskaffes i henhold til lokale retningslinjer.
Administration
Intravenøs infusion eller injektion.
Intravenøs administration af Fibryga skal ske langsomt, idet den anbefalede maksimale indgivelseshastighed er 5 ml pr. minut for patienter med medfødt hypo- eller afibrinogenæmi og 10 ml pr. minut for patienter med erhvervet fibrinogenmangel.
Uforligeligheder
Dette lægemiddel må ikke blandes med andre lægemidler.
Revisionsdato
Denne indlægsseddel blev senest ændret 11/2023.