Feiba®
pulver og solvens til infusionsvæske, opløsning 100 enheder/ml
Baxalta
Om indlægssedlen
INDLÆGSSEDDEL: INFORMATION TIL BRUGEREN
Feiba 100 enheder pr. ml pulver og solvens til infusionsvæske, opløsning
Faktor VIII inhibitor bypassing aktivitet
Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
- Gem indlægssedlen. Du kan få brug for at læse den igen.
- Spørg lægen eller apotekspersonalet, hvis der er mere, du vil vide.
- Lægen har ordineret dette lægemiddel til dig personligt. Lad derfor være med at give lægemidlet til andre. Det kan være skadeligt for andre, selvom de har de samme symptomer, som du har.
- Kontakt lægen eller apotekspersonalet, hvis du får bivirkninger, herunder bivirkninger, som ikke er nævnt i denne indlægsseddel. Se punkt 4.
Se den nyeste indlægsseddel på www.indlaegsseddel.dk.
Oversigt over indlægssedlen
- Virkning og anvendelse
- Det skal du vide, før du begynder at bruge Feiba
- Sådan skal du bruge Feiba
- Bivirkninger
- Opbevaring
- Pakningsstørrelser og yderligere oplysninger
1. Virkning og anvendelse
Feiba er et præparat fremstillet af humant plasma, som tillader hæmostase, selv hvis individuelle koagulationsfaktorer er reduceret eller mangler.
Feiba anvendes til behandling og forebyggelse af blødninger hos inhibitor hæmofili A patienter.
Feiba anvendes til behandling af blødninger hos inhibitor hæmofili B patienter.
Feiba anvendes til behandling og forebyggelse af blødninger hos patienter uden hæmofilisygdom med erhvervede faktor VIII inhibitorer.
Feiba anvendes desuden til forebyggelse ved kirurgiske indgreb hos inhibitor hæmofili A patienter.
Feiba kan anvendes til alle aldersgrupper.
2. Det skal du vide, før du begynder at bruge Feiba
Fortæl det til din læge, hvis du har en kendt allergi.
Hvis du er på en natrium-kontrolleret diæt, skal du informere din læge herom.
Brug ikke Feiba
I følgende situationer bør Feiba kun anvendes, hvis der - for eksempel på grund af en meget høj inhibitortiter - ikke kan forventes noget respons på behandling med det relevante koagulationsfaktorkoncentrat:
- hvis du er allergisk (overfølsom) over for faktor VIII inhibitor bypassing aktivitet eller et af de øvrige indholdsstoffer i Feiba (angivet i punkt 6).
- hvis du har dissemineret intravaskulær koagulation (DIC) (DIC = konsumptionskoagulopati, en livstruende tilstand, hvor der opstår for kraftig blodkoagulation med udtalt dannelse af blodpropper i blodkarrene. Dette medfører et øget forbrug af koagulationsfaktorer i hele kroppen.).
- i tilfælde af myokardieinfarkt, akut trombose og/eller emboli: Feiba bør kun anvendes ved livstruende blødningsepisoder.
Advarsler og forsigtighedsregler
Kontakt lægen, før du bruger Feiba, da der kan opstå overfølsomhedsreaktioner, hvilket kan ske med alle intravenøst indgivne plasmaprodukter. For at kunne genkende en allergisk reaktion hurtigst muligt skal du være opmærksom på de mulige tidlige symptomer på overfølsomhedsreaktioner, såsom
- hudrødmen (erytem)
- hududslæt
- udbrud af nældefeber på huden (urticaria)
- kløe over hele kroppen
- hævelse af læber og tunge
- besværet vejrtrækning/dyspnø
- trykken for brystet
- ildebefindende generelt
- svimmelhed
- faldende blodtryk
Øvrige symptomer på overfølsomhedsreaktioner på plasmaderivater inkluderer letargi og rastløshed.
Hvis du oplever nogen af disse symptomer, skal infusionen straks stoppes og du skal kontakte lægen med det samme. Ovennævnte symptomer kan være de første tegn på et anafylaktisk shock. Svære symptomer kræver akut behandling omgående.
Lægen vil kun bruge Feiba igen hos patienter med formodet overfølsomhed over for produktet eller nogen af dets indholdsstoffer, efter en grundig afvejning af de forventede fordele og risici ved genbehandling og/eller hvis der ikke kan forventes effekt af en anden forebyggende behandling eller alternative behandling.
- Hvis du oplever store ændringer i blodtrykket eller hjerterytmen, vejrtrækningsbesvær, hoste eller smerter i brystet, skal infusionen straks stoppes, og du skal kontakte lægen med det samme. Lægen vil igangsætte den nødvendige diagnosticering og behandling.
- Hos patienter med inhibitor hæmofili eller med erhvervede inhibitorer mod koagulationsfaktorer. Under behandling med Feiba kan disse patienter have en øget blødningstendens og en øget risiko for trombose på samme tid.
Under behandling med Feiba er der forekommet trombotiske og tromboemboliske hændelser, herunder dissemineret intravaskulær koagulation (DIC), venøs trombose, lungeemboli. myokardieinfarkt og slagtilfælde. Samtidig anvendelse af rekombinant faktor VIIa (rFVIIa) vil sandsynligvis øge risikoen for en tromboembolisk hændelse. Nogle af de trombotiske og tromboemboliske hændelser er forekommet ved behandling med høje doser af Feiba.
I en undersøgelse foretaget af et andet selskab for at evaluere emicizumab (et lægemiddel til forebyggelse af blødning hos patienter med hæmofili A) blev nogle patienter, der led af gennembrudsblødninger, behandlet med Feiba for at kontrollere blødningerne, og nogle få af disse patienter udviklede trombotisk mikroangiopati (TMA). TMA er en alvorlig og potentielt livstruende tilstand. Når mennesker har denne tilstand, kan formen af blodkarrene blive beskadiget, og blodpropper kan udvikle sig i de små blodkar. I nogle tilfælde kan dette forårsage skade på nyrerne og andre organer. I tilfælde af gennembrudsblødninger mens du er i forebyggende behandling med emicizuma, skal du straks kontakte din hæmofili behandler eller dit hæmofili behandlingscenter.
Når medicin fremstilles af humant blod eller plasma, tages der visse forholdsregler for at forhindre, at der overføres infektioner til patienter. Disse omfatter omhyggelig udvælgelse af blod- og plasmadonorer for at sikre, at personer med risiko for at være bærere af infektioner udelukkes, samt test af hver enkelt bloddonation og plasmapulje for tegn på virus/infektioner. Producenterne af disse produkter inkluderer desuden trin i behandlingen af blodet og plasmaet, som kan inaktivere eller fjerne vira. På trods af disse forholdsregler kan muligheden for overførsel af infektion ikke helt udelukkes, når der anvendes medicin fremstillet af humant blod eller plasma. Dette gælder også eventuelle ukendte eller nyopdagede vira eller andre typer af infektioner.
Forholdsreglerne anses for effektive over for indkapslede vira, såsom hiv (humant immundefektvirus), hepatitis B-virus og hepatitis C-virus, og over for det ikke-indkapslede hepatitis A-virus. Forholdsreglerne kan være af begrænset værdi over for ikke-indkapslede vira såsom parvovirus B19. Infektion med parvovirus B19 kan være alvorlig for gravide kvinder (fosterinfektion) og for personer, hvis immunsystem er undertrykt, eller som har visse typer anæmi (f.eks. seglcelleanæmi eller hæmolytisk anæmi).
Din læge vil muligvis anbefale, at du overvejer vaccination mod hepatitis A og B, hvis du regelmæssigt eller flere gange får faktor VIII inhibitor-produkter, der stammer fra humant plasma.
Efter indgivelse af høje doser Feiba kan den forbigående stigning i de passivt overførte hepatitis B overfladeantistoffer resultere i misvisende tolkning af positive resultater i serologiske tests.
Feiba er et produkt fremstillet fra blodplasma og kan indeholde stoffer, der reagerer, når de indgives i patienter, hvilket forårsager tilstedeværelsen af isohæmagglutininer (antistoffer, der forårsager adhæsion af røde blodlegemer fra en anden person). Denne proces kan føre til vildledende resultater i blodprøver.
Hver gang du får en dosis Feiba, anbefales det på det kraftigste, at navn og batchnummer på produktet registreres for at opretholde en fortegnelse over de anvendte batcher.
Børn
Der er begrænset erfaring hos børn under 6 år. Den samme doseringsplan, der anvendes til voksne, skal tilpasses barnets kliniske tilstand.
Brug af andre lægemidler sammen med Feiba
Fortæl altid lægen eller apotekspersonalet, hvis du bruger andre lægemidler, for nylig har brugt andre lægemidler eller planlægger at bruge andre lægemidler.
Der er ikke udført tilstrækkelige og velkontrollerede studier af kombineret eller sekventiel anvendelse af Feiba og rekombinant faktor VIIa antifibrinolytika eller emicizumab. Risikoen for trombotiske hændelser skal tages i betragtning, når systemiske antifibrinolytika såsom tranexamsyre og aminocapronsyre anvendes samtidig med Feiba. Derfor bør antifibrinolytika ikke anvendes i de første ca. 6-12 timer efter indgivelse af Feiba.
I tilfælde af samtidig anvendelse af rFVIIa kan en potentiel lægemiddelinteraktion ikke udelukkes i henhold til de tilgængelige in vitro data og kliniske observationer (resulterer potentielt i en tromboembolisk hændelse). Fortæl altid lægen, hvis du skal behandles med Feiba, efter at du har været behandlet med emicizumab (et lægemiddel til forebyggelse af blødning hos patienter med hæmofili A), da der er specifikke advarsler og forholdsregler, der skal overvejes. Din læge skal overvåge dig nøje.
Som med alle blodkoagulationspræparater bør Feiba ikke sammenblandes med andre lægemidler inden indgivelse, da virkningen af og toleransen for præparatet kan blive reduceret.
Det tilrådes at skylle en almindelig venøs adgang med en fysiologisk saltopløsning før og efter indgivelsen af Feiba.
Graviditet, amning og frugtbarhed
Hvis du er gravid eller ammer, har mistanke om, at du er gravid, eller planlægger at blive gravid, skal du spørge din læge eller apotekspersonalet til råds, før du bruger dette lægemiddel.
Din læge afgør, om du kan bruge Feiba under graviditet og amning. På grund af den øgede risiko for trombose under graviditet bør Feiba kun indgives under omhyggelig lægelig overvågning, og kun hvis det er absolut nødvendigt. Information vedrørende parvovirus B19 infektion er angivet under advarsler og forsigtighedsregler.
Trafik- og arbejdssikkerhed
Feiba påvirker ikke arbejdssikkerheden eller evnen til at færdes sikkert i trafikken.
Feiba indeholder natrium
500 enheder
Dette lægemiddel indeholder cirka 40 mg natrium (hovedkomponent af madlavnings-/bordsalt) pr. hætteglas. Dette svarer til 2 % af den anbefalede maksimale daglige indtagelse af natrium for en voksen.
1.000 enheder
Dette lægemiddel indeholder cirka 80 mg natrium (hovedkomponent af madlavnings-/bordsalt) pr. hætteglas. Dette svarer til 4 % af den anbefalede maksimale daglige indtagelse af natrium for en voksen.
2.500 enheder
Dette lægemiddel indeholder cirka 200 mg natrium (hovedkomponent af madlavnings-/bordsalt) pr. hætteglas. Dette svarer til 10 % af den anbefalede maksimale daglige indtagelse af natrium for en voksen.
3. Sådan skal du bruge Feiba
Rekonstituèr det frysetørrede Feiba pulver med vedlagte solvens og indgiv opløsningen intravenøst.
Brug altid Feiba nøjagtigt efter lægens anvisning. Er du i tvivl, så spørg lægen eller apotekspersonalet.
Lægen har fastlagt den dosis og de dosisintervaller, der er påkrævet for dig personligt, under hensyntagen til alvorsgraden af din blodkoagulationsforstyrrelse, blødningens placering og omfang samt din generelle tilstand og din respons på præparatet. Du må ikke ændre den dosering, lægen har fastlagt, og du må ikke afbryde anvendelsen af dette præparat på egen hånd.
Tal med lægen eller apotekspersonalet, hvis du mener, at virkningen af Feiba er for stærk eller for svag.
Opvarm om nødvendigt produktet til stue- eller kropstemperatur inden indgivelse.
Feiba skal rekonstitueres umiddelbart inden indgivelse. Opløsningen bør anvendes straks (da præparatet ikke indeholder konserveringsmidler).
Sving forsigtigt rundt, indtil alt stof er opløst. Kontrollér, at Feiba er fuldstændig opløst, ellers vil færre Feiba enheder passere gennem udstyrets filter.
Opløsninger, der er uklare eller har aflejringer, skal kasseres på den relevante måde.
Åbnede beholdere må ikke genbruges.
Brug kun det vedlagte vand til injektionsvæsker og det vedlagte udstyrssæt til rekonstitution.
Hvis der anvendes andet udstyr end det vedlagte, skal man sørge for at bruge et egnet filter med en porestørrelse på mindst 149 µm.
Produktet må ikke anvendes, hvis dets sterile spærresystem er blevet brudt, hvis pakningen er beskadiget, eller hvis produktet viser tegn på nedbrydning.
Må ikke opbevares i køleskab efter rekonstitution.
Når Feiba er helt rekonstitueret, skal injektion eller infusion af lægemidlet påbegyndes straks og skal gennemføres inden for tre timer efter rekonstitutionen.
Ikke anvendt lægemiddel samt affald heraf skal bortskaffes i henhold til lokale retningslinjer.
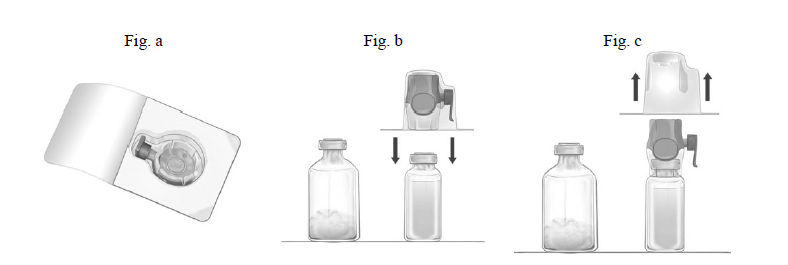
Rekonstitution af pulveret til klargøring af infusionsvæske, opløsning med BAXJECT II Hi-Flow:
- Opvarm det uåbnede hætteglas indeholdende solvens (vand til injektionsvæsker) til stuetemperatur eller til maksimal +37 °C, hvis nødvendigt, f.eks. flere minutter i vandbad.
- Fjern beskyttelseshætterne fra hætteglassene med pulver og solvens, og desinficer gummipropperne på begge hætteglas. Placer hætteglassene på en jævn overflade.
- Åbn pakken med BAXJECT II Hi-Flow ved at trække papirlåget af uden at røre indholdet (fig. a). Fjern ikke overføringsudstyret fra pakken i dette trin.
- Vend pakken om og tryk den klare plastspike gennem gummiproppen på solvensglasset (fig. b). Fjern emballagen fra BAXJECT II Hi-Flow (Fig. c). Fjern ikke den blå beskyttelseshætte fra BAXJECT II Hi-Flow i dette trin.
- Vend herefter systemet, som består af BAXJECT II Hi-Flow og solvensglasset således, at solvensglasset er øverst. Tryk den lilla plastspike på BAXJECT II Hi-Flow gennem Feiba hætteglasset. Vakuummet vil trække solvensen ind i Feiba hætteglasset (fig. d).
- Sving forsigtigt systemet rundt uden at ryste det, indtil pulveret er opløst. Sørg for, at Feiba er fuldstændig opløst, ellers kan aktivt materiale sidde fast i udstyrets filter.
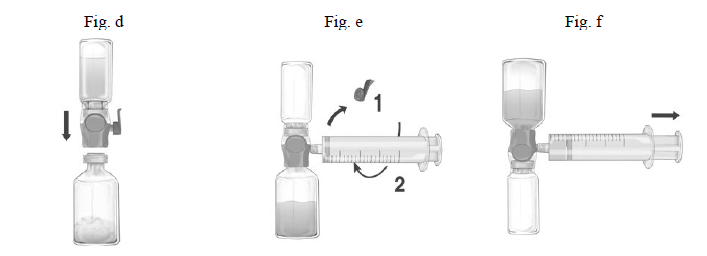
Infusion
Aseptisk teknik skal anvendes under hele proceduren!
- Fjern den blå beskyttelseshætte på BAXJECT II Hi-Flow. Sprøjten sammenkobles tæt med BAXJECT II Hi-Flow. DER MÅ IKKE TRÆKKES LUFT IND I SPRØJTEN (Fig. e). For at sikre en tæt sammenkobling mellem sprøjten og BAXJECT II Hi-Flow udstyret anbefales det kraftigt at bruge en luer-lock sprøjte (ved montering drejes sprøjten med urets retning, indtil den når stop-positionen).
- Vend systemet om, så det opløste produkt er øverst. Træk det opløste produkt ind i sprøjten ved at trække stemplet LANGSOMT tilbage. Sørg for, at den tætte sammenkobling mellem BAXJECT II Hi-Flow udstyret og sprøjten opretholdes under hele trækkeprocessen (Fig. f).
- Fjern sprøjten fra BAXJECT II.
- Hvis produktet skummer i sprøjten, skal du vente, til skummet er faldet sammen. Indgiv opløsningen intravenøst ved lav hastighed ved hjælp af det vedlagte infusionssæt.
Overstig ikke en infusionshastighed på 10 enheder Feiba pr. kg legemsvægt pr. minut.
Hvis du har brugt for meget Feiba
Kontakt straks din læge. Overdosering af Feiba kan forøge risikoen for bivirkninger såsom tromboemboli (blodpropdannelse i blodkarrene), konsumptionskoagulopati (DIC) eller myokardieinfarkt Nogle af de indberettede tromboemboliske hændelser er forekommet ved doser over 200 enheder pr. kg eller hos patienter med andre risikofaktorer for tromboemboliske hændelser. Hvis der ses tegn eller symptomer på trombotiske eller tromboemboliske hændelser, skal infusionen straks afbrydes og passende diagnosticering og behandling initieres.
4. Bivirkninger
Dette lægemiddel kan som alle andre lægemidler give bivirkninger, men ikke alle får bivirkninger.
Almindelige bivirkninger (forekommer hos op til 1 ud af 10 patienter)
Overfølsomhed, hovedpine, svimmelhed, lavt blodtryk (hypotension), udslæt, positivt testresultat for antistoffer mod hepatitis B.
Bivirkninger med ikke kendt hyppighed (kan ikke estimeres ud fra forhåndenværende data)
- Blod- og lymfesystem: Konsumptionskoagulopati (DIC), stigning i inhibitor titer
- Immunsystemet: Anafylaktiske reaktioner, nældefeber over hele kroppen (urticaria)
- Nervesystemet: Følelsesløshed i arme og ben (hypoæstesi), unormal eller reduceret følsomhed (paræstesi), slagtilfælde (trombotisk slagtilfælde, embolisk slagtilfælde), søvnighed (somnolens), smagsforstyrrelser (dysgeusi)
- Hjerte: Hjerteanfald (myokardieinfarkt), hjertebanken (takykardi)
- Vaskulære sygdomme: Blodpropdannelse i blodkarrene (tromboemboliske hændelser, venøs og arteriel trombose), blodtryksstigning (hypertension), rødmen
- Luftveje, thorax og mediastinum: Tillukning af lungearterien (lungeemboli), forsnævring i luftvejene (bronkospasme), hvæsende vejrtrækning, hoste, åndenød (dyspnø)
- Mave-tarm-kanalen: Opkastning, diarré, abdominalt ubehag, kvalme
- Hud og subkutane væv: Følelsesløshed i ansigtet, hævelse i ansigt, tunge og læber (angioødem), nældefeber over hele kroppen (urticaria), kløe (pruritus)
- Almene symptomer og reaktioner på administrationsstedet: Smerte ved injektionsstedet, generel utilpashed, varmefølelse, kuldegysninger, feber, brystsmerter, ubehag i brystregionen
- Undersøgelser: Faldende blodtryk, øget indhold af fibrin D-dimer i blodet
Hurtig intravenøs infusion kan forårsage stikkende smerte og følelsesløshed i ansigtet og ekstremiteter samt blodtryksfald.
Myokardieinfarkter blev observeret efter administration af doser over den maksimale daglige dosis og/eller forlænget anvendelse og/eller tilstedeværelse af risikofaktorer for tromboemboli.
Indberetning af bivirkninger
Hvis du oplever bivirkninger, bør du tale med din læge. Dette gælder også mulige bivirkninger, som ikke er medtaget i denne indlægsseddel. Du eller dine pårørende kan også indberette bivirkninger direkte til Lægemiddelstyrelsen via:
Danmark
Lægemiddelstyrelsen
Axel Heides Gade 1
DK-2300 København S
Websted: www.meldenbivirkning.dk
Ved at indrapportere bivirkninger kan du hjælpe med at fremskaffe mere information om sikkerheden af dette lægemiddel.
5. Opbevaring
Opbevar lægemidlet utilgængeligt for børn.
Må ikke opbevares ved temperaturer over 25 °C. Må ikke nedfryses.
Opbevares i den originale yderpakning for at beskytte mod lys.
Brug ikke lægemidlet efter den udløbsdato, der står på etiketten og pakningen. Udløbsdatoen er den sidste dag i den nævnte måned.
Spørg apotekspersonalet, hvordan du skal bortskaffe lægemiddelrester. Af hensyn til miljøet må du ikke smide lægemiddelrester i afløbet, toilettet eller skraldespanden.
6. Pakningsstørrelser og yderligere oplysninger
Feiba indeholder:
Pulver
- Aktivt stof i hvert hætteglas: faktor VIII inhibitor bypassing aktivitet.
- 1 ml indeholder 100 enheder faktor VIII inhibitor bypassing aktivitet.
- Feiba 100 enheder pr. ml fås i tre forskellige pakningsstørrelser:
- Pakningsstørrelsen 500 enheder Feiba indeholder 500 enheder faktor VIII inhibitor bypassing aktivitet i 200-600 mg humant plasmaprotein.
- Pakningsstørrelsen 1.000 enheder Feiba indeholder 1.000 enheder faktor VIII inhibitor bypassing aktivitet i 400-1.200 mg humant plasmaprotein.
- Pakningsstørrelsen 2.500 enheder Feiba indeholder 2.500 enheder faktor VIII inhibitor bypassing aktivitet i 1.000-3.000 mg humant plasmaprotein.
Feiba indeholder også faktor II, IX og X, hovedsageligt i ikke-aktiveret form og som aktiveret faktor VII. Både faktor VIII koagulant antigen (FVIII C:ag) og kallikrein-kinin system faktorer er kun til stede i spormængder, hvis overhovedet.
- Øvrige indholdsstoffer: natriumchlorid og natriumcitrat.
Solvens
- Vand til injektionsvæsker
Udseende og pakningsstørrelser
Produktet er et hvidt til råhvidt eller grønligt frysetørret pulver eller letsmuldrende fast stof. Den færdige opløsning har en pH-værdi mellem 6,5 og 7,3.
Pulver og solvens leveres i engangshætteglas, som er lukket med gummipropper.
Pakningsstørrelse:
1 × 500 enheder
1 × 1.000 enheder
1 × 2.500 enheder
Ikke alle pakningsstørrelser er nødvendigvis markedsført.
Pakningens indhold:
- 1 hætteglas med 500 enheder/1.000 enheder/2.500 enheder Feiba pulver til infusionsvæske, opløsning
- 1 hætteglas med 5 ml/10 ml/25 ml vand til injektionsvæsker
- 1 BAXJECT II Hi-Flow til rekonstitution
- 1 engangssprøjte
- 1 sommerfuglekanyle
Indehaver af markedsføringstilladelsen og fremstiller
Oplysninger tiltænkt læger og sundhedspersonale
Nedenstående oplysninger er til sundhedspersoner:
Behandlingen skal initieres under opsyn af en læge med erfaring i behandling af koagulationsforstyrrelser.
Dosering
Doseringen og varigheden af behandlingen afhænger af den hæmostatiske forstyrrelses sværhedsgrad, blødningens placering og udstrækning samt patientens kliniske tilstand.
Doseringen og indgivelseshyppigheden skal altid tage højde for den kliniske effekt i hvert enkelt tilfælde.
Som generel retningslinje anbefales en dosis på 50-100 enheder Feiba pr. kg legemsvægt. En enkeltdosis må ikke overskride 100 enheder pr. kg legemsvægt, og den maksimale daglige dosis må ikke overskride 200 enheder pr. kg legemsvægt, medmindre blødningens alvorsgrad giver anledning til og berettiger anvendelse af højere doser.
Responset på et bypassing-produkt kan variere på grund af patientspecifikke faktorer, og i en given blødningssituation kan patienter, som har utilstrækkelig respons på et produkt, muligvis respondere på et andet produkt. I tilfælde af utilstrækkeligt respons på et Bypassing-produkt bør det overvejes at bruge et andet produkt.
Pædiatrisk population
Der er begrænset erfaring hos børn under 6 år. Samme dosisregime som for voksne skal tilpasses til barnet kliniske tilstand.
1) Spontan blødning
Blødning i led, muskler og blødt væv
Til behandling af mindre til moderate blødninger anbefales en dosis på 50-75 enheder pr. kg legemsvægt indgivet med 12 timers intervaller. Behandlingen skal fortsætte, indtil der er en klar forbedring af de kliniske symptomer, f.eks. mindre smerter, mindre hævelse eller bedre bevægelighed i leddene.
Ved alvorlige blødninger i muskler og blødt væv, f.eks. retroperitoneale blødninger, anbefales en dosis på 100 enheder pr. kg legemsvægt indgivet med 12 timers intervaller.
Slimhindeblødning
Det anbefales at give en dosis på 50 enheder pr. kg legemsvægt hver 6. time under nøje overvågning af patienten (visuel kontrol af blødning, gentagen måling af hæmatokrit). Såfremt blødning ikke ophører, kan dosis øges til 100 enheder pr. kg legemsvægt. Dog må den maksimale daglige dosis på 200 enheder pr. kg legemsvægt ikke overskrides.
Andre alvorlige blødninger
Ved alvorlige blødninger såsom CNS-blødninger anbefales en dosis på 100 enheder pr. kg legemsvægt indgivet med 12 timers intervaller. I enkelte tilfælde kan Feiba gives med 6 timers intervaller, indtil der opnås en klar forbedring af den kliniske tilstand (Den maksimale daglige dosis på 200 enheder pr. kg legemsvægt må ikke overskrides!).
2) Kirurgisk indgreb
Ved kirurgiske indgreb kan der præoperativt administreres en startdosis på 100 enheder pr. kg legemsvægt, og en yderligere dosis på 50-100 enheder pr. kg legemsvægt kan gives efter 6-12 timer. Som postoperativ vedligeholdelsesdosis kan der gives 50-100 enheder pr. kg legemsvægt med 6-12 timers intervaller. Doseringen, dosisintervallerne og varigheden af den peri- og postoperative behandling er afhængig af det kirurgiske indgreb, patientens generelle tilstand og den kliniske effekt i hvert enkelt tilfælde (Den maksimale dosis på 200 enheder pr. kg legemsvægt må ikke overskrides!).
3) Profylakse hos hæmofili A patienter med inhibitorer
- Blødningsprofylakse hos patienter med en høj inhibitortiter og hyppige blødninger efter fejlslagen immunologisk toleransterapi (ITI) eller hvor ITI ikke overvejes:
Den anbefalede dosis er 70-100 enheder pr. kg legemsvægt hver anden dag. Om nødvendigt kan dosis øges til 100 enheder pr. kg legemsvægt pr. dag, eller den kan reduceres gradvist. - Blødningsprofylakse hos patienter med en høj inhibitortiter under immunologisk toleransterapi (ITI):
Feiba kan administreres samtidig med faktor VIII behandling inden for dosisområdet 50-100 enheder pr. kg legemsvægt to gange dagligt, indtil faktor VIII inhibitortiter er blevet reduceret til < 2 BE.*
* 1 Bethesda-enhed defineres som den mængde antistof, som inhiberer 50 % af faktor VIII aktiviteten i inkuberet plasma (2 timer ved 37 °C).
4) Brug af Feiba hos særlige patientgrupper
Feiba er også blevet anvendt i kombination med faktor VIII koncentrat til langtidsbehandling for at opnå fuldstændig og permanent eliminering af faktor VIII inhibitoren.
Monitorering
I tilfælde af utilstrækkeligt respons på behandling med produktet anbefales det at foretage en blodpladetælling, idet et tilstrækkeligt antal funktionelt intakte blodplader betragtes som nødvendigt for produktets virkning.
På grund af den komplekse virkningsmekanisme findes der ikke nogen direkte monitorering af aktive indholdsstoffer. Koagulationstests såsom den fuldsblods koaguleringstid (WBCT), tromboelastogram (TEG, r-værdi) og aktiveret partiel tromboplastintid viser sædvanligvis kun en mindre reduktion, og har ikke nødvendigvis en sammenhæng med den kliniske virkning. Derfor har disse tests kun begrænset værdi ved monitorering af behandlingen med Feiba.
Administration
Feiba skal gives langsomt intravenøst. Feiba skal administreres ved en infusionshastighed på 2 enheder pr. kg legemsvægt pr. minut. Hos patienter, hvor en infusionshastighed på 2 enheder pr. kg legemsvægt pr. minut er veltolereret, kan hastigheden ved efterfølgende infusioner øges til maksimalt 10 enheder pr. kg legemsvægt pr. minut.
Feiba skal rekonstitueres umiddelbart inden administrationen. Opløsningen bør anvendes straks (da præparatet ikke indeholder konserveringsmidler). Brug ikke opløsninger, som er uklare eller har udfældninger. Ikke anvendte lægemidler samt affald heraf bør destrueres i henhold til lokale retningslinjer.
Monitorering af behandling
Enkeltdoser på 100 enheder pr. kg legemsvægt og daglige doser på 200 enheder pr. kg legemsvægt må ikke overskrides. Patienter som modtager 100 enheder pr. kg legemsvægt eller mere skal overvåges omhyggeligt, især med hensyn til udvikling af DIC og/eller akut koronar iskæmi og for symptomer på andre trombotiske eller tromboemboliske hændelser. Høje doser Feiba bør kun gives, så længe det er absolut påkrævet for at stoppe en blødning.
I tilfælde af klinisk signifikante ændringer i blodtryk eller puls, åndenød, hoste eller brystsmerter skal infusionen straks afbrydes og passende diagnosticering og behandling skal initieres. De signifikante laboratorieparametre for DIC er fald i fibrinogen, fald i trombocyttal og/eller tilstedeværelse af nedbrydningsprodukter af fibrin/fibrinogen (FDP). Øvrige parametre for DIC er en tydeligt forlænget trombintid, protrombintid eller aktiveret partiel tromboplastintid. Hos patienter med inhibitor hæmofili eller med erhvervede faktor VIII, IX og/eller XI inhibitorer forlænges aktiveret partiel tromboplastintid af den underliggende sygdom.
Indgivelse af Feiba hos patienter med inhibitorer kan resultere i en initial anamnetisk stigning i inhibitorer. Ved fortsat behandling med Feiba kan der ses et fald i inhibitorer over tid. Kliniske og publicerede data tyder på, at virkningen af Feiba ikke reduceres.
Patienter med inhibitor hæmofili eller med erhvervede inhibitorer mod koagulationsfaktorer, som behandles med Feiba, kan have øget blødningstendens samt øget risiko for trombose på samme tid.
Laboratorietests og klinisk virkning
In vitro-tests såsom aktiveret partiel tromboplastintid, koaguleringstid for fuldblod (WBCT), tromboelastogram (TEG) som evidens for virkning har ikke nødvendigvis en sammenhæng med det kliniske billede. Derfor vil forsøg på at normalisere disse værdier ved at øge dosis af Feiba ikke lykkes, og sådanne forsøg skal definitivt afvises på grund af den mulige risiko for at fremkalde DIC ved overdosering.
Trombocyttallets signifikans
I tilfælde af utilstrækkeligt respons på behandling med Feiba anbefales det at foretage en trombocyttælling, idet et tilstrækkeligt antal funktionelt intakte trombocytter er nødvendigt for virkningen af Feiba.
Behandling af hæmofili B patienter med inhibitorer
Erfaringen med faktor IX inhibitorer hos hæmofili B patienter er begrænset på grund af sygdommens sjældenhed. Fem hæmofili B patienter med inhibitorer blev behandlet med Feiba i kliniske studier, enten efter behov, profylaktisk eller i forbindelse med kirurgiske indgreb:
I et prospektivt open-label, randomiseret, klinisk parallelstudie med hæmofili A eller B patienter med vedvarende høj titerinhibitor (090701, PROOF) blev 36 patienter randomiseret til enten 12 måneders ± 14 dage profylaktisk behandling eller behandling efter behov. De 17 patienter i den profylaktiske arm modtog 85 ± 15 E/kg Feiba, som blev indgivet hver anden dag, og de 19 patienter i efter-behov-armen blev behandlet individuelt som fastlagt af lægen. To hæmofili B patienter med inhibitorer blev behandlet i efter-behov-armen, og en hæmofili B patient blev behandlet i den profylaktiske arm. Median-ABR (årlig blødningsrate) for alle typer af blødningsepisoder hos patienterne i den profylaktiske arm (median-ABR = 7,9) var lavere end hos patienterne i efter-behov-armen (median-ABR = 28,7), hvilket svarer til en 72,5 % reduktion i median-ABR mellem de to behandlingsarme.
I et andet udført ikke-intervenerende observationsstudie med perioperativ anvendelse af Feiba (PASS-INT-003, SURF) blev der udført i alt 34 kirurgiske indgreb hos 23 patienter. Størstedelen af patienterne (18) var patienter med medfødt hæmofili A med inhibitorer, 2 var hæmofili B patienter med inhibitorer, og 3 var patienter med erhvervet hæmofili A med inhibitorer. Feiba-eksponeringen varede fra 1 til 28 dage med et gennemsnit på 9 dage og en median på 8 dage. Den gennemsnitlige kumulative dosis var 88.347 E og mediandosen var 59.000 E. Hos hæmofili B patienter med inhibitorer var den længste eksponering for Feiba 21 dage, og den maksimale anvendte dosis var 7.324 E.
Derudover er der rapporteret om 48 patienter i litteraturen, hvor Feiba blev anvendt til behandling og forebyggelse af blødningsepisoder hos hæmofili B patienter med faktor IX inhibitor (34 hæmofili B patienter med inhibitorer blev behandlet efter behov, 6 hæmofili B patienter med inhibitorer blev behandlet profylaktisk, og 8 hæmofili B patienter med inhibitorer blev behandlet i forbindelse med kirurgiske indgreb).
Tolerabiliteten og sikkerheden af Feiba, rekonstituteret i almindelig eller 50 % reduceret volumen, og hurtigere infusionshastigheder hos hæmofilipatienter med inhibitorer blev undersøgt i et prospektivt, åbent og randomiseret overkrydsningsstudie (091501). Treogtredive patienter blev behandlet, og otteogtyve patienter gennemførte studiet. I studiet blev Feiba rekonstitueret i 50 % reduceret volumen (100 enheder/ml koncentration) og administreret i.v. ved infusionshastigheder på 2, 4 og 10 enheder/kg/min. ved den deklarerede dosis på 85 enheder/kg ± 15 enheder/kg for alle patienter. De primære endepunkter var tolerabilitet og sikkerhed med den 50 % reducerede volumen (øget koncentration) ved standardhastighed og øget hastighed. Studiet påviste, at både den højere koncentration (100 enheder/ml) og de højere infusionshastigheder (4 og 10 enheder/kg/min.) var veltolererede, og sikkerhedsprofilen var sammenlignelig ved den deklarerede dosis på 85 enheder/kg ± 15 enheder/kg. De patienter, der fik den 50 % reducerede volumen (øget koncentration) ved standardinfusionshastigheden på 2 enheder/kg/min. havde lignende hyppigheder af relaterede behandlingsbetingede bivirkninger (TEAE’er) sammenlignet med dem, der fik den almindelige volumen (koncentration på 50 enheder/ml) ved samme infusionshastighed. Der blev ikke indberettet nogen relaterede TEAE’er ved infusionshastigheden på 4 enheder/kg/min. Hos patienter, der fik den 50 % reducerede volumen (100 enheder/ml) ved infusionshastigheden på 10 enheder/kg/min., sås 1 relateret, ikke-alvorlig TEAE. Derudover oplevede de patienter, der fik den 50 % reducerede volumen (øget koncentration) ved de øgede infusionshastigheder på 4 og 10 enheder/kg/min., ikke nogen alvorlige TEAE’er, overfølsomhedsreaktioner, reaktioner på infusionsstedet, trombotiske TEAE’er eller nogen TEAE’er, der medførte seponering af lægemidlet eller afbrydelse af studiet. Samlet set stemte de TEAE’er, der blev set i studiet, overens med Feibas kendte bivirkningsprofil hos hæmofilipatienter med inhibitorer.
I et åbent, ukontrolleret, non-interventionelt observationsstudie efter markedsføring af Feiba (PASS-EU-006) blev 75 patienter (gennemsnitsalder på 34,8 år, 70 mænd og 5 kvinder), af hvilke 73 havde hæmofili A med inhibitorer og 2 havde hæmofili B med inhibitorer, behandlet med Feiba. Ud af de 65 patienter med medfødt hæmofili havde 63 medfødt hæmofili A og 2 havde medfødt hæmofili B. Ved baseline fik 43 patienter ordineret Feiba som profylakse, og 32 fik ordineret Feiba som behandling efter behov. Højere infusionshastigheder (> 2 enheder/kg/min.) blev anvendt hos 6 pædiatriske patienter i alderen mellem 11 måneder og 11 år og hos 5 unge i alderen 13 til 16 år.
Ud af 320 infusioner med en tilgængelig infusionshastighed hos 7 pædiatriske og 6 unge patienter var der 129 infusioner (40,3 %) hos 2 patienter (begge pædiatriske) med en infusionshastighed > 10 enheder/kg/min., 26 infusioner (8,1 %) hos 7 patienter (4 pædiatriske, 3 unge) med en infusionshastighed > 4 og ≤ 10 enheder/kg/min., 135 infusioner (42,2 %) hos 7 patienter (3 pædiatriske, 4 unge) med en infusionshastighed > 2 og ≤ 4 enheder/kg/min. og 30 infusioner (9,4 %) hos 3 patienter (1 pædiatrisk, 2 unge) med en infusionshastighed ≤ 2 enheder/kg/min.
Der er også enkelte rapporter om anvendelse af Feiba til behandling af patienter med erhvervede faktor IX, X, XI og XIII inhibitorer.
I sjældne tilfælde er Feiba også blevet anvendt hos patienter med tilstedeværelse af inhibitor af von Willebrand-faktor.
Revisionsdato
Denne indlægsseddel blev senest ændret: 12/2024.


