ADZYNMA®
pulver og opløsning til injektionsvæske, opløsning 500 IE og 1500 IE
Takeda Manufacturing Austria AG
Om indlægssedlen
Indlægsseddel: Information til brugeren
ADZYNMA 500 IE pulver og solvens til injektionsvæske, opløsning
ADZYNMA 1 500 IE pulver og solvens til injektionsvæske, opløsning
rADAMTS13
▼Dette lægemiddel er underlagt supplerende overvågning. Dermed kan der hurtigt tilvejebringes nye oplysninger om sikkerheden. Du kan hjælpe ved at indberette alle de bivirkninger, du får. Se sidst i punkt 4, hvordan du indberetter bivirkninger.
Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
- Gem indlægssedlen. Du kan få brug for at læse den igen
- Spørg lægen, apotekspersonalet eller sygeplejersken, hvis der er mere, du vil vide.
- Lægen har ordineret dette lægemiddel til dig personligt. Lad derfor være med at give lægemidlet til andre. Det kan være skadeligt for andre, selvom de har de samme symptomer, som du har.
- Kontakt lægen, apotekspersonalet eller sygeplejersken, hvis du får bivirkninger, herunder bivirkninger, som ikke er nævnt i denne indlægsseddel. Se punkt 4.
Se den nyeste indlægsseddel på www.indlaegsseddel.dk.
Oversigt over indlægssedlen
- Virkning og anvendelse
- Det skal du vide, før du begynder at bruge ADZYNMA
- Sådan skal du bruge ADZYNMA
- Bivirkninger
- Opbevaring
- Pakningsstørrelser og yderligere oplysninger
- Brugsanvisning
1. Virkning og anvendelse
ADZYNMA indeholder det aktive stof rADAMTS13, som er en kunstig kopi af det naturlige enzym (protein) ADAMTS13. Dette enzym mangler hos personer med medfødt trombotisk trombocytopenisk purpura (cTTP).
Medfødt TTP er en meget sjælden arvelig blodsygdom, hvor der dannes blodpropper i små blodkar i hele kroppen. Disse blodpropper kan blokere for tilførslen af blod og ilt til kroppens organer, hvilket kan medføre, at antallet af blodplader (blodbestanddele, som hjælper blodet med at størkne) i blodet bliver lavere end normalt.
Medfødt TTP skyldes mangel på enzymet ADAMTS13 i blodet. ADAMTS13 bidrager til at forebygge blodpropper ved at nedbryde store molekyler kaldet von Willebrand faktor (VWF). Når VWF- molekyler er for store, kan de forårsage dannelse af farlige blodpropper. ADZYNMA bruges til at genoprette niveauet af det manglende ADAMTS13. Dette bidrager til at nedbryde disse store molekyler til mindre molekyler, hvilket reducerer sandsynligheden for dannelse af blodpropper og forebygger potentielt lave blodpladeniveauer hos patienter med cTTP.
2. Det skal du vide, før du begynder at bruge ADZYNMA
Brug ikke ADZYNMA
- hvis du har oplevet alvorlige eller potentielt livstruende allergiske reaktioner over for rADAMTS13 eller et af de øvrige indholdsstoffer i ADZYNMA (angivet i punkt 6).
Advarsler og forsigtighedsregler
Kontakt lægen, apotekspersonalet eller sygeplejersken, før du bruger ADZYNMA.
Allergiske reaktioner
Der er risiko for, at du kan opleve en allergisk overfølsomhedsreaktion over for ADZYNMA. Din læge bør informere dig om tidlige tegn på alvorlige allergiske reaktioner såsom:
- hurtig puls
- trykken for brystet
- hvæsende vejrtrækning og/eller pludselig opståen af åndedrætsbesvær
- lavt blodtryk
- nældefeber, udslæt og kløende hud
- løbende næse eller tilstoppet næse
- røde øjne
- nysen
- hurtig hævelse under huden i områder som f.eks. ansigtet, halsen, armene og benene
- træthed
- kvalme
- opkastning
- fornemmelser såsom følelsesløshed, snurren, prikken og stikken
- rastløshed
- anafylaksi (alvorlig allergisk reaktion, der kan forårsage synke- og/eller åndedrætsbesvær, rødt eller hævet ansigt og/eller røde eller hævede hænder).
Hvis nogen af disse symptomer opstår, vil din læge beslutte, om din behandling med ADZYNMA skal stoppes, og give dig de rette lægemidler til behandling af den allergiske reaktion. Alvorlige symptomer, herunder åndedrætsbesvær og svimmelhed, kræver hurtig nødbehandling.
Hæmmere
Neutraliserende antistoffer (kaldet hæmmere) kan dannes hos nogle patienter, der får ADZYNMA. Disse hæmmere kan potentielt forårsage, at behandlingen holder op med at virke korrekt. Fortæl det til din læge, hvis du tror, dit lægemiddel ikke virker for dig.
Brug af andre lægemidler sammen med ADZYNMA
Fortæl det altid til lægen eller apotekspersonalet, hvis du bruger andre lægemidler, for nylig har brugt andre lægemidler eller planlægger at bruge andre lægemidler.
Graviditet og amning
Hvis du er gravid eller ammer, har en formodning om, at du er gravid, eller planlægger at blive gravid, skal du spørge din læge eller apotekspersonalet til råds, før du tager dette lægemiddel.
Du må ikke få ADZYNMA under graviditet, medmindre din læge specifikt anbefaler det. Du og din læge skal beslutte, om du kan bruge ADZYNMA, hvis du ammer.
Trafik- og arbejdssikkerhed
Dette lægemiddel påvirker muligvis i mindre grad evnen til at føre motorkøretøj og betjene maskiner. Der kan forekomme svimmelhed og døsighed (søvnighed) efter brug af ADZYNMA.
Registrering
For at forbedre sporbarheden af biologiske lægemidler skal lægemidlets navn og batchnummer tydeligt registreres.
ADZYNMA indeholder natrium
Dette lægemiddel indeholder mindre end 1 mmol (23 mg) natrium pr. hætteglas, dvs. det er i det væsentlige natriumfrit.
ADZYNMA indeholder polysorbat 80
Dette lægemiddel indeholder 2,7 mg polysorbat 80 per hætteglas med ADZYNMA 500 IE eller 1 500 IE, hvilket svarer til op til 0,216 mg/kg. Polysorbater kan medføre allergiske reaktioner. Fortæl det til lægen, hvis du har nogen allergier.
3. Sådan skal du bruge ADZYNMA
Behandling med ADZYNMA vil blive givet til dig under opsyn af en læge, der har erfaring med behandling af patienter med blodsygdomme.
ADZYNMA gives ved intravenøs (i en vene) injektion. Det leveres til din læge som et pulver, der skal opløses (rekonstitueres) med det medfølgende solvens (en væske, der er i stand til at opløse pulveret), før det indgives.
Dosis beregnes ud fra din kropsvægt.
Indgivelse af lægemidlet hjemme
Din læge kan vurdere, at du kan bruge ADZYNMA hjemme hos dig selv, hvis du tolererer dine injektioner godt. Når du selv er i stand til at injicere ADZYNMA (eller det indgives til dig af en plejeperson) efter passende oplæring udført af den behandlende læge og/eller sygeplejerske, vil din læge fortsætte med at overvåge din reaktion på behandlingen. Hvis du får bivirkninger, når du tager lægemidlet hjemme hos dig selv, skal du straks stoppe injektionen og kontakte en sundhedsperson.
Anbefalet dosis
Forebyggende enzymerstatningsterapi
Den sædvanlige dosis er 40 IE pr. kg kropsvægt, som indgives hver anden uge.
Din læge kan ændre hyppigheden til én gang om ugen, hvis ADZYNMA hver anden uge ikke virker for dig.
Behovsbaseret enzymerstatningsterapi til pludselige TTP-episoder
Hvis du får en pludselig trombotisk trombocytopenisk purpura (TTP)-episode, er den anbefalede dosis af ADZYNMA som følger:
- 40 IE/kg kropsvægt på dag 1.
- 20 IE/kg kropsvægt på dag 2.
- 15 IE/kg kropsvægt fra dag 3 én gang dagligt indtil to dage efter, at den pludselige TTP-episode er ophørt.
Hvis du har taget for meget ADZYNMA
Overdosering af dette lægemiddel kan resultere i blødning.
Hvis du har glemt at bruge ADZYNMA
Hvis du har glemt en injektion af ADZYNMA, skal du fortælle det til din læge så hurtigt som muligt. Du må ikke tage en dobbeltdosis som erstatning for den glemte dosis.
Hvis du holder op med at bruge ADZYNMA
Tal med din læge, hvis du ønsker at stoppe behandlingen med ADZYNMA. Symptomerne på din sygdom kan forværres, hvis du stopper behandlingen.
Spørg lægen, apotekspersonalet eller sygeplejersken, hvis der er noget, du er i tvivl om.
4. Bivirkninger
Dette lægemiddel kan som alle andre lægemidler give bivirkninger, men ikke alle får bivirkninger.
Følgende bivirkninger er blevet rapporteret med ADZYNMA:
Meget almindelige (kan forekomme hos flere end 1 ud af 10 personer)
- næse- og halsinfektion
- hovedpine
- følelse af svimmelhed
- migræne
- diarré
- kvalme
Almindelige (kan forekomme hos op til 1 ud af 10 personer)
- højt antal blodplader i blodet (trombocytose)
- søvnighed
- forstoppelse
- oppustethed (maveudspiling)
- svækkelse (asteni)
- varmefølelse
- unormal ADAMTS13-aktivitet
Indberetning af bivirkninger
Hvis du oplever bivirkninger, bør du tale med din læge, apotekspersonalet eller sygeplejersken. Dette gælder også mulige bivirkninger, som ikke er medtaget i denne indlægsseddel. Du eller dine pårørende kan også indberette bivirkninger direkte til
Lægemiddelstyrelsen
Axel Heides Gade 1
DK-2300 København S
Websted: www.meldenbivirkning.dk
Ved at indrapportere bivirkninger kan du hjælpe med at fremskaffe mere information om sikkerheden af dette lægemiddel.
5. Opbevaring
Opbevar lægemidlet utilgængeligt for børn.
Brug ikke lægemidlet efter den udløbsdato, der står på etiketten og æsken efter EXP. Udløbsdatoen er den sidste dag i den nævnte måned.
Uåbnede hætteglas
Opbevares i køleskab (2 °C - 8 °C).
Må ikke nedfryses.
Opbevares i den originale yderpakning for at beskytte mod lys.
De uåbnede hætteglas med ADZYNMA-pulver kan opbevares ved almindelig stuetemperatur (op til 30 °C) i en periode på op til 6 måneder, men udløbsdatoen må ikke overskrides. ADZYNMA må ikke sættes tilbage i køleskabet efter opbevaring ved stuetemperatur. Notér den dato, hvor ADZYNMA tages ud af køleskabet, på kartonen.
Efter rekonstitution
Kassér ubrugt rekonstitueret produkt efter 3 timer.
Brug ikke lægemidlet, hvis du bemærker, at det ikke er klart og farveløst.
Spørg apotekspersonalet, hvordan du skal bortskaffe lægemiddelrester. Af hensyn til miljøet må du ikke smide lægemiddelrester i afløbet, toilettet eller skraldespanden.
6. Pakningsstørrelser og yderligere oplysninger
ADZYNMA indeholder:
- Det aktive stof, rADAMTS13, er en oprenset, rekombinant, human ADAMTS13 (A disintegrin and metalloproteinase with thrombospondin motifs 13).
Hvert hætteglas med pulver indeholder 500 eller 1 500 IE nominel rADAMTS13-aktivitet. - Hætteglasset med solvens indeholder 5 ml vand til injektionsvæsker.
- Øvrige indholdsstoffer (hjælpestoffer): natriumchlorid, calciumchloriddihydrat, L-histidin, mannitol, saccharose og polysorbat 80 (E433). Se punkt 2 ”ADZYNMA indeholder natrium” og ”ADZYNMA indeholder polysorbat 80”.
Udseende og pakningsstørrelser
ADZYNMA leveres som pulver og solvens til injektionsvæske, opløsning. Pulveret er et hvidt frysetørret pulver. Solvensen er klar og farveløs.
Hver pakke indeholder et hætteglas med pulver, et hætteglas med solvens, et udstyr til rekonstitution (BAXJECT II Hi-Flow), en engangssprøjte, et infusionssæt og to renseservietter.
Indehaver af markedsføringstilladelsen og fremstiller
Takeda Manufacturing Austria AG
Industriestrasse 67
1221 Wien
Østrig
Hvis du ønsker yderligere oplysninger om dette lægemiddel, skal du henvende dig til den lokale repræsentant for indehaveren af markedsføringstilladelsen:
Takeda Pharma A/S
Tlf.: +45 46 77 10 10
medinfoEMEA@takeda.com
Dette lægemiddel er godkendt under ”særlige vilkår”. Det betyder, at det grundet sygdommens sjældenhed ikke har været muligt at opnå fyldestgørende oplysninger om dette lægemiddel. Det Europæiske Lægemiddelagentur vil hvert år vurdere nye oplysninger om lægemidlet, og denne indlægsseddel vil om nødvendigt blive ajourført.
Andre informationskilder
Du kan finde yderligere oplysninger om dette lægemiddel på Det Europæiske Lægemiddelagenturs hjemmeside: https://www.ema.europa.eu og på Lægemiddelstyrelsens hjemmeside http://www.laegemiddelstyrelsen.dk. Der er også links til andre websteder om sjældne sygdomme og om, hvordan de behandles.
Brugsanvisning
Denne brugsanvisning indeholder oplysninger om, hvordan man rekonstituerer og infunderer ADZYNMA.
Denne brugsanvisning er beregnet til sundhedspersonale og til patienter/plejepersoner, som vil administrere ADZYNMA i hjemmet efter korrekt oplæring udført af en sundhedsperson.
Behandling med ADZYNMA bør ordineres og overvåges af en sundhedsperson, der har erfaring med behandling af patienter med blodsygdomme.
Vigtigt:
- Kun til intravenøs injektion efter rekonstitution.
- Anvend aseptisk teknik under hele proceduren.
- Kontroller produktets udløbsdato før brug.
- Brug ikke ADZYNMA, hvis udløbsdatoen er overskredet.
- Hvis patienten har brug for mere end ét hætteglas med ADZYNMA pr. injektion, skal hvert hætteglas rekonstitueres i henhold til instruktionerne under ”Rekonstitution”.
- Kontrollér den rekonstituerede ADZYNMA-opløsning for partikler og misfarvning, før den administreres. Opløsningen skal være klar og farveløs af udseende.
- Må ikke administreres, hvis der observeres partikler eller misfarvning.
- Brug ADZYNMA inden for 3 timer efter rekonstitution, når produktet opbevares ved stuetemperatur.
- ADZYNMA må ikke administreres i samme slange eller beholder samtidig med andre lægemidler til infusion.
Rekonstitution
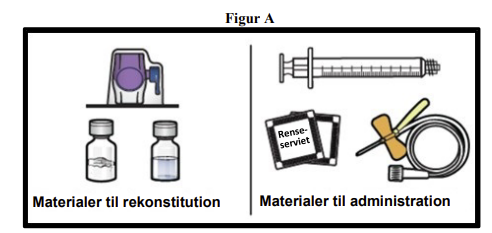
1. Klargør en ren, plan overflade, og hent alle de materialer, du skal bruge til rekonstitution og administration (figur A).
2. Lad hætteglassene med ADZYNMA og fortyndingsmiddel nå stuetemperatur før brug.
3. Vask og tør dine hænder grundigt.
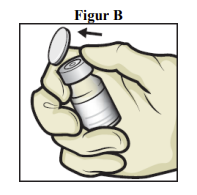
4. Fjern plasthætterne fra hætteglassene med ADZYNMA og fortyndingsmiddel, og placer hætteglassene på en plan overflade (figur B).
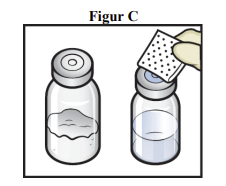
5. Tør gummipropperne af med en renseserviet, og lad dem tørre inden brug. (figur C).
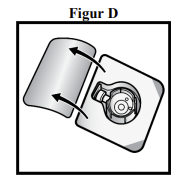
6. Åbn emballagen med BAXJECT II Hi-Flow-udstyret ved at trække låget af uden at røre ved indersiden (figur D).
- Fjern ikke BAXJECT II Hi-Flow-udstyret fra emballagen.
- Rør ikke ved den transparente plastspids.
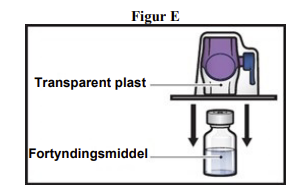
7. Vend emballagen med BAXJECT II Hi-Flow-udstyret på hovedet, og placer den over toppen af hætteglasset med fortyndingsmiddel. Tryk lige ned, indtil den transparente plastspids gennemtrænger proppen på hætteglasset med fortyndingsmiddel (figur E).
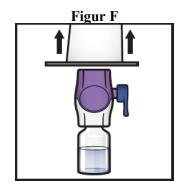
8. Tag fat i kanten af emballagen til BAXJECT II Hi-Flow-udstyret, og træk emballagen af udstyret (figur F).
- Fjern ikke den blå hætte på BAXJECT II Hi-Flow-udstyret.
- Rør ikke ved den blottede lilla plastspids.
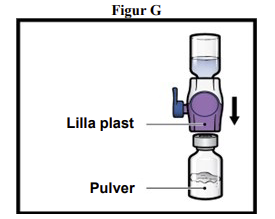
9. Vend systemet om, så hætteglasset med fortyndingsmiddel nu er øverst. Tryk BAXJECT II Hi-Flow-udstyret lige ned, indtil den lilla plastspids gennemtrænger proppen på hætteglasset med ADZYNMA-pulver (figur G). Undertrykket vil trække fortyndingsmidlet ind i hætteglasset med ADZYNMA-pulver.
- Du vil muligvis bemærke nogle bobler eller skum - det er normalt og bør snart forsvinde.
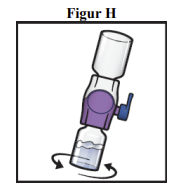
10. Sving de forbundne hætteglas forsigtigt og kontinuerligt rundt, indtil pulveret er helt opløst (figur H).
- Omryst ikke hætteglasset.
11. Kontrollér den rekonstituerede opløsning visuelt for partikler før administration.
- Brug ikke produktet, hvis der observeres partikler eller misfarvning.
12. Hvis dosis kræver mere end ét hætteglas med ADZYNMA, skal hvert hætteglas rekonstitueres ved at følge ovenstående trin.
- Brug et nyt BAXJECT II Hi-Flow-udstyr til at rekonstituere hvert hætteglas med ADZYNMA og fortyndingsmiddel.
Administration af ADZYNMA
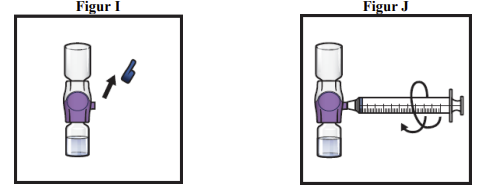
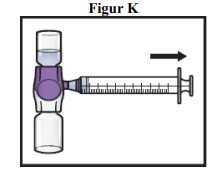
13. Tag den blå hætte af BAXJECT II Hi-Flow-udstyret (figur I). Sæt en Luer-lock-sprøjte på (figur J).
- Injicer ikke luft i systemet.
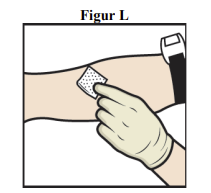
14. Vend systemet på hovedet (hætteglasset med ADZYNMA er nu øverst). Træk den rekonstituerede opløsning ind i sprøjten ved langsomt at trække stemplet tilbage (figur K).
15. Hvis en patient skal modtage mere end ét hætteglas med ADZYNMA, kan indholdet af flere hætteglas trækkes ind i den samme sprøjte. Gentag denne proces for alle rekonstituerede hætteglas med ADZYNMA, indtil den samlede mængde, der skal administreres, er nået.
16. Frakobl sprøjten, og sæt en passende kanyle eller et infusionssæt på.
17. Vend kanylen opad, og fjern eventuelle luftbobler ved at banke let med en finger på sprøjten og langsomt og forsigtigt presse luften ud af sprøjten gennem kanylen.
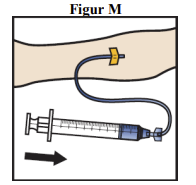
18. Placer en tourniquet, og rens det valgte injektionssted med en renseserviet (figur L).
19. Indsæt kanylen i venen, og fjern tourniqueten.
20. Infunder det rekonstituerede ADZYNMA langsomt med en hastighed på 2 til 4 ml pr. minut (figur M).
- Der kan bruges en sprøjtepumpe til at regulere administrationshastigheden.
21. Tag kanylen ud af venen, og læg pres på injektionsstedet i flere minutter.
- Sæt ikke hætten tilbage på kanylen.
Opbevaring af ADZYNMA
- Opbevar ADZYNMA i køleskab (2 °C - 8 °C) eller ved almindelig stuetemperatur (op til 30 °C) i en periode på op til 6 måneder.
- ADZYNMA må ikke sættes tilbage i køleskabet efter opbevaring ved stuetemperatur.
- Notér den dato, hvor ADZYNMA tages ud af køleskabet, på kartonen.
- Må ikke nedfryses.
- Opbevares i den originale yderpakning for at beskytte mod lys.
- Må ikke bruges efter den udløbsdato, der står på etiketten og æsken efter EXP.
- Brug ADZYNMA inden for 3 timer efter rekonstitution. Kassér ubrugt rekonstitueret produkt, hvis det ikke bruges inden for 3 timer efter rekonstitution.
Bortskaffelse af ADZYNMA
- Hætteglassene er kun til engangsbrug.
- Bortskaf den brugte kanyle, sprøjten og de tomme hætteglas i en beholder til skarpe genstande, der sikret mod perforation.
- Spørg apotekspersonalet, hvordan du skal bortskaffe lægemiddelrester. Af hensyn til miljøet må du ikke smide lægemiddelrester i afløbet, toilettet eller skraldespanden.
Revisionsdato
Denne indlægsseddel blev senest ændret 08/2024.