Lumigan®
øjendråber, opløsning 0,1 mg/ml
AbbVie
Om indlægssedlen
Indlægsseddel: Information til patienten
LUMIGAN® 0,1 mg/ml øjendråber, opløsning
bimatoprost
Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
- Gem indlægssedlen. Du kan få brug for at læse den igen.
- Spørg lægen eller apotekspersonalet, hvis der er mere, du vil vide.
- Lægen har ordineret dette lægemiddel til dig personligt. Lad derfor være med at give lægemidlet til andre. Det kan være skadeligt for andre, selvom de har de samme symptomer, som du har.
- Kontakt lægen eller apotekspersonalet, hvis du får bivirkninger, herunder bivirkninger, som ikke er nævnt i denne indlægsseddel. Se punkt 4.
Se den nyeste indlægsseddel på www.indlaegsseddel.dk.
Oversigt over indlægssedlen
- Virkning og anvendelse
- Det skal du vide, før du begynder at bruge LUMIGAN
- Sådan skal du bruge LUMIGAN
- Bivirkninger
- Opbevaring
- Pakningsstørrelser og yderligere oplysninger
1. Virkning og anvendelse
LUMIGAN er et lægemiddel til behandling af glaukom (grøn stær). Det tilhører en gruppe lægemidler, der kaldes prostamider.
LUMIGAN øjendråber anvendes til at sænke forhøjet tryk i øjet. Dette lægemiddel kan anvendes alene eller sammen med øjendråber, som kaldes beta- blokkere, der også nedsætter trykket.
Øjet indeholder en klar, vandig væske, som giver næring til øjet. Væsken løber konstant ud af øjet, og der dannes ny væske som erstatning. Såfremt væsken ikke kan løbe hurtigt nok væk, stiger trykket i øjet. Dette lægemiddel virker ved at øge den mængde væske, der løber væk. Hermed nedsættes trykket i øjet. Såfremt det forhøjede tryk ikke nedsættes, kan det medføre en sygdom, der hedder grøn stær (glaukom), og måske skade dit syn.
2. Det skal du vide, før du begynder at bruge LUMIGAN
Brug ikke LUMIGAN
- hvis du er allergisk over for bimatoprost eller et af de øvrige indholdsstoffer i LUMIGAN (angivet i punkt 6).
- hvis du tidligere har måttet ophøre med at anvende øjendråber på grund af konserveringsmidlet benzalkoniumchlorid.
Advarsler og forsigtighedsregler
Kontakt lægen eller apotekspersonalet, før du bruger LUMIGAN, hvis
- Du har åndedrætsproblemer.
- Du har lever- eller nyreproblemer.
- Du tidligere er blevet opereret for grå stær.
- Du har tørre øjne.
- Du har eller har haft problemer med din hornhinde (den forreste gennemsigtige del af øjet).
- Du bruger kontaktlinser (se ”LUMIGAN indeholder benzalkoniumchlorid”).
- Du har eller har haft lavt blodtryk eller langsom hjerterytme (puls).
- Du har haft en virusinfektion eller betændelse i øjet.
Under behandling kan LUMIGAN forårsage tab af fedtvæv omkring øjet, hvilket kan medføre, at din øjenlågsfure bliver dybere, dine øjne ser indsunkne ud (enoftalmi), dine øverste øjenlåg kommer til at hænge (ptose), huden omkring dine øjne bliver stram (involution af dermatochalase), og at den
nederste hvide del af dine øjne bliver mere synlig (synlig inferior sclera). Forandringerne er typisk milde, men hvis de er udtalte, kan de påvirke synsfeltet. Forandringerne kan forsvinde, hvis du holder op med at bruge LUMIGAN. LUMIGAN kan måske forårsage, at dine øjenvipper bliver mørkere og vokser, samt få huden omkring øjenlåget til at blive mørkere. Farven på regnbuehinden (iris) kan også blive mørkere. Disse forandringer kan måske blive permanente. Forandringerne bemærkes mere, såfremt kun det ene øje behandles.
Børn og unge
LUMIGAN er ikke afprøvet på børn under 18 år og bør derfor ikke anvendes af patienter under 18 år.
Brug af andre lægemidler sammen med LUMIGAN
Fortæl det altid til lægen eller apotekspersonalet, hvis du bruger andre lægemidler, for nylig har brugt andre lægemidler eller planlægger at bruge andre lægemidler.
Graviditet og amning
Hvis du er gravid eller ammer, har mistanke om, at du er gravid, eller planlægger at blive gravid, skal di spørge din læge eller apotekspersonalet til råds, før du bruger dette lægemiddel.
LUMIGAN udskilles måske i mælken og må derfor ikke anvendes af ammende kvinder.
Trafik- og arbejdssikkerhed
Dit syn kan blive sløret i en kort periode lige efter inddrypning af LUMIGAN. Derfor bør du ikke føre motorkøretøj eller betjene maskiner, før synet er klart igen.
LUMIGAN indeholder benzalkoniumchlorid
Dette lægemiddel indeholder 0,6 mg benzalkoniumchlorid i hver 3 ml opløsning, svarende til 0,2 mg/ml.
Anvend ikke øjendråberne samtidig med, at du bærer kontaktlinser. Benzalkoniumchlorid, som er et konserveringsmiddel i LUMIGAN, kan absorberes af bløde kontaktlinser og kan ændre farven af kontaktlinserne. du skal tage kontaktlinserne ud, inden lægemidlet bruges, og vente mindst 15 minutter, før du sætter kontaktlinserne i igen. Benzalkoniumchlorid kan også give øjenirritation, især hvis du har tørre øjne eller problemer med hornhinderne (det klare lag forrest i øjet). Hvis du har unormale fornemmelser i øjet såsom svie eller smerte, når du bruger dette lægemiddel, skal du tale med din læge.
3. Sådan skal du bruge LUMIGAN
Brug altid lægemidlet nøjagtigt efter lægens eller apotekspersonalets anvisning. Er du i tvivl, så spørg lægen eller apotekspersonalet.
LUMIGAN må kun anvendes som øjendråber. Den anbefalede dosis er 1 dråbe LUMIGAN én gang daglig om aftenen i det øje/de øjne, som skal behandles.
Hvis du bruger LUMIGAN sammen med andre øjenlægemidler, skal der gå mindst fem minutter imellem, at du bruger LUMIGAN og det andet øjenlægemiddel.
Du må ikke bruge LUMIGAN mere end én gang dagligt, da det kan nedsætte behandlingens virkning.
Brugsvejledning:
Anvend ikke flasken, hvis forseglingen på flaskehalsen er brudt, før den tages i brug første gang.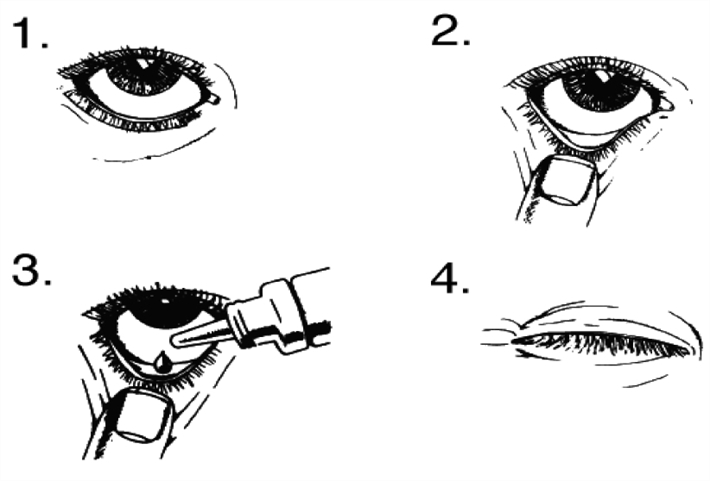
- Vask hænderne. Læg hovedet tilbage og se op i loftet.
- Træk forsigtigt det nederste øjenlåg ned, så der dannes en lille lomme.
- Vend flasken og tryk for at udløse 1 dråbe i øjet.
- Slip det nederste øjenlåg, og luk øjet i 30 sekunder.
Eventuelt overskydende lægemiddel, som løber ned ad kinden, skal tørres væk.
Såfremt dråben løber ved siden af øjet, dryppes igen.
For at undgå infektioner og øjenskade må flaskespidsen ikke berøre øjet eller andet. Skru hætten på igen umiddelbart efter brug.
Hvis du har brugt for meget LUMIGAN
Hvis du har brugt for meget LUMIGAN, er det usandsynligt, at det skulle forårsage nogen skade. Næste dosis tages på det sædvanlige tidspunkt. Hvis du er bekymret, så kontakt din læge eller apotekspersonalet.
Hvis du har glemt at bruge LUMIGAN
Hvis du har glemt at bruge LUMIGAN, inddryppes en enkelt dråbe, så snart du husker det. Fortsæt derefter den normale rutine. Du må ikke bruge en dobbeltdosis som erstatning for den glemte dosis.
Hvis du holder op med at bruge LUMIGAN 0,1
LUMIGAN bør bruges hver dag for at opnå fuld effekt. Hvis du holder op med at bruge LUMIGAN, kan trykket i dit øje stige. Tal derfor med din læge, inden behandlingen afbrydes.
Spørg lægen eller apotekspersonalet, hvis der er noget, du er i tvivl om.
4. Bivirkninger
Dette lægemiddel kan som alle andre lægemidler give bivirkninger, men ikke alle får bivirkninger.
Meget almindelige(kan forekomme hos flere end 1 ud af 10 personer)
Bivirkninger i øjet
- Let rødme (hos op til 29 %)
- Tab af fedtvæv i øjenområdet, som kan føre til fordybning af øjenlågsfuren, indfaldne øjne (enoftalmi), hængende øjenlåg (ptose), stramning af huden omkring øjet (involution af dermatochalase), og den nederste hvide del af øjet bliver mere synlig (synlig inferior sclera)
Almindelige (kan forekomme hos op til 1 ud af 10 personer)
Bivirkninger i øjet
- Små brud i øjets slimhinde med eller uden betændelse
- Irritation
- Kløende øjne
- Længere øjenvipper
- Irritation nå øjet dryppes
- Smerter.
Bivirkninger i huden
- Røde og kløende øjenlåg
- Mørkere hudfarve rundt om øjet
- Hårvækst rundt om øjet.
Ikke almindelige (kan forekomme hos op til 1 ud af 100 personer)
Bivirkninger i øjet
- Mørkere farve på iris
- Træthed i øjet
- Hævelse af øjets overflade
- Sløret syn
- Tab af øjenvipper.
Bivirkninger på huden
- Tør hud
- Skorpedannelse på kanten af øjenlåget
- Hævet øjenlåg
- Kløe.
Bivirkninger i kroppen
- Hovedpine
- Kvalme.
Ikke kendte (hyppighed kan ikke estimeres ud fra forhåndenværende data)
Bivirkninger i øjet
- Makulaødem (hævelse af nethinden bagerst i øjet, der kan give dårligere syn)
- Mørkere farve på øjenlåget
- Tørre øjne
- Klistrede øjne
- En fornemmelse af at have noget i øjet
- Hævelse af øjet
- Øget tåredannelse
- Ubehag i øjnene
- Øget lysfølsomhed.
Bivirkninger i kroppen
- Astma
- Forværring af astma
- Forværring af lungesygdommen kaldet kronisk obstruktiv lungesygdom (KOL)
- Kortåndethed
- Symptomer på allergisk reaktion (hævelse, røde øjne og hududslæt)
- Svimmelhed
- Forhøjet blodtryk
- Misfarvning af huden rundt om øjet.
Ud over bivirkningerne for LUMIGAN 0,1 mg/ml har man set følgende bivirkninger ved lægemidler, der indeholder en større mængde bimatoprost (0,3 mg/ml):
- En brændende fornemmelse i øjet
- En allergisk reaktion i øjet
- Betændte øjenlåg
- Besvær med at se klart
- Forværring af synet
- Hævelse af det gennemsigtige lag, der dækker øjet
- Tåreflåd
- Mørkere øjenvipper
- Nethindeblødning
- Vævsirritation i øjet
- Cystoidt makulaødem (nethinden i øjet svulmer op, så man får dårligere syn)
- Sitrende øjenlåg
- Øjenlåget krymper og bevæger sig væk fra øjets overflade
- Rødme af huden omkring øjet
- Mathed
- Forhøjede blodprøver for leverfunktion.
Andre bivirkninger indberettet fra øjendråber, der indeholder fosfater.
I meget sjældne tilfælde har nogle patienter med alvorlige skader på den forreste klare del af øjet (hornhinden) i løbet af behandlingen udviklet uklare pletter på hornhinden, som skyldes dannelse af kalk.
Indberetning af bivirkninger
Hvis du oplever bivirkninger, bør du tale med din læge, apotekspersonalet eller sygeplejersken. Dette gælder også mulige bivirkninger, som ikke er medtaget i denne indlægsseddel. Du eller dine pårørende kan også indberette bivirkninger direkte til Lægemiddelstyrelsen via Lægemiddelstyrelsen
Axel Heides Gade 1
DK-2300 København S
Websted: www.meldenbivirkning.dk.
Ved at indrapportere bivirkninger kan du hjælpe med at fremskaffe mere information om sikkerheden af dette lægemiddel.
5. Opbevaring
Opbevar lægemidlet utilgængeligt for børn.
Brug ikke lægemidlet efter den udløbsdato, der står på flaskens etiket og på kartonen efter EXP. Udløbsdatoen er den sidste dag i den nævnte måned.
Flasken skal kasseres senest fire uger efter første åbning, selv om der stadig er nogle øjendråber tilbage. Dette forhindrer infektion. For at huske datoen for første åbning bør du skrive denne dato ned i feltet på kartonen.
Spørg apotekspersonalet, hvordan du skal bortskaffe lægemiddelrester. Af hensyn til miljøet må du ikke smide lægemiddelrester i afløbet, toilettet eller skraldespanden.
6. Pakningsstørrelser og yderligere oplysninger
LUMIGAN indeholder:
- Aktivt stof: Bimatoprost. 1 ml opløsning indeholder 0,1 mg bimatoprost.
- Øvrige indholdsstoffer: Benzalkoniumchlorid (konserveringsmiddel), natriumchlorid, dinatriumphosphatheptahydrat, citronsyremonohydrat og renset vand. Der kan tilsættes små mængder saltsyre eller natriumhydroxid for at holde syreniveauet (pH-niveauet) normalt (se punkt 2).
Udseende og pakningsstørrelser
LUMIGAN er en farveløs, klar øjendråbeopløsning i en pakning, der indeholder enten 1 plastflaske eller 3 plastflasker med skruelåg. Hver flaske er ca. halvt fyldt og indeholder 3 ml opløsning. Det er tilstrækkeligt til 4-ugers forbrug. Ikke alle pakningsstørrelser er nødvendigvis markedsført.
Indehaveren af markedsføringstilladelsen og fremstiller
Indehaver af markedsføringstilladelsen
AbbVie Deutschland GmbH & Co. KG
Knollstrasse
67061 Ludwigshafen
Tyskland
Fremstiller
Allergan Pharmaceuticals Ireland
Castlebar Road
Westport
Co. Mayo
Irland
Paralleldistributør:
2care4 ApS, Esbjerg V Danmark
Ompakker:
2care4 ApS, Esbjerg V Danmark
LUMIGAN® er et registreret varemærke, der tilhører ALLERGAN, INC.
Hvis du ønsker yderligere oplysninger om dette lægemiddel, skal du henvende dig til den lokale repræsentant for indehaveren af markedsføringstilladelsen:
Danmark
AbbVie A/S
Tlf.: +45 72 30 20 28
Du kan finde yderligere oplysninger om dette lægemiddel på Det Europæiske Lægemiddelagenturs hjemmeside http://www.ema.europa.eu.
For at lytte til eller rekvirere en kopi af denne indlægsseddel stor skrift (magnaprint), kontakt venligst den lokale repræsentant for indehaveren af markedsføringstilladelsen.
Revisionsdato
Denne indlægsseddel blev senest ændret 11/2024.


