AKANTIOR®
øjendråber, opløsning, enkeltdosisbeholder 0,8 mg/ml
SIFI S.p.A.
Om indlægssedlen
Indlægsseddel: Information til patienten
AKANTIOR 0,8 mg/ml øjendråber, opløsning i enkeltdosisbeholder
polihexanid
Læs denne indlægsseddel grundigt, inden du begynder at bruge dette lægemiddel, da den indeholder vigtige oplysninger.
- Gem indlægssedlen. Du kan få brug for at læse den igen.
- Spørg lægen eller apotekspersonalet, hvis der er mere, du vil vide.
- Lægen har ordineret dette lægemiddel til dig personligt. Lad derfor være med at give lægemidlet til andre. Det kan være skadeligt for andre, selvom de har de samme symptomer, som du har.
- Kontakt lægen eller apotekspersonalet, hvis du får bivirkninger, herunder bivirkninger, som ikke er nævnt i denne indlægsseddel. Se punkt 4.
Oversigt over indlægssedlen
- Virkning og anvendelse
- Det skal du vide, før du begynder at bruge AKANTIOR
- Sådan skal du bruge AKANTIOR
- Bivirkninger
- Opbevaring
- Pakningsstørrelser og yderligere oplysninger
1. Virkning og anvendelse
AKANTIOR indeholder det aktive stof polihexanid.
AKANTIOR anvendes til voksne og børn fra 12 år til behandling af Acanthamoeba-keratitis, Acanthamoeba er en parasit (lille organisme, der lever i mennesker og kan forårsage sygdom), som kan forårsage en infektion, der fører til keratitis (betændelse i hornhinden, det klare lag foran i øjet). Acanthamoeba-keratitis kan forårsage alvorlige defekter på hornhindens overflade, herunder sår (åbne sår).
AKANTIOR beskadiger membranen (den ydre hud) på Acanthamoeba-parasitten, hvilket fører til, at celleindholdet lækker, hvilket ødelægger cellen. AKANTIOR forhindrer også Acanthamoeba- parasitten i at lave kopier af sit dna ved at påvirke enzymer (proteiner), der er ansvarlige for replikationsprocessen, hvilket stopper parasittens vækst og reproduktion hos mennesker.
2. Det skal du vide, før du begynder at bruge AKANTIOR
Brug ikke AKANTIOR
hvis du er allergisk over for polihexanid eller et af de øvrige indholdsstoffer i AKANTIOR (angivet i punkt 6)
Advarsler og forsigtighedsregler
Kontakt lægen eller apotekspersonalet, før du bruger AKANTIOR.
Behandling med AKANTIOR kan forårsage, at du får let til moderat ubehag i øjet (såsom øjensmerter) og røde øjne. Hvis du oplever en svær øjenreaktion, skal du kontakte lægen.
Børn og unge
AKANTIOR bør ikke anvendes til børn under 12 år, da det ikke er blevet undersøgt til denne aldersgruppe.
Brug af andre lægemidler sammen med AKANTIOR
Fortæl det altid til lægen eller apotekspersonalet, hvis du bruger andre lægemidler, for nylig har brugt andre lægemidler eller planlægger at bruge andre lægemidler.
Hvis du bruger andre øjendråber, skal du vente mindst 5 minutter mellem påføring af AKANTIOR og de andre dråber. AKANTIOR skal administreres sidst,
Graviditet og amning
Der er ingen erfaring med at bruge AKANTIOR til gravide kvinder. AKANTIOR bør ikke anvendes under graviditeten. Hvis du er gravid eller ammer, har mistanke om, at du er gravid, eller planlægger at blive gravid, skal du spørge din læge eller apotekspersonalet til råds, før du tager dette lægemiddel.
Det er ukendt, om AKANTIOR udskilles i modermælk. Spørg din læge eller apotekspersonalet til råds før behandling med AKANTIOR.
Trafik- og arbejdssikkerhed
Dit syn kan blive midlertidigt sløret efter brug af AKANTIOR. Undgå at føre motorkøretøj eller betjene maskiner, indtil du igen kan se klart.
AKANTIOR indeholder phosphater
Dette lægemiddel indeholder 0,37 mg phosphater pr. dråbe, svarende til 10,66 mg/ml. Hvis du lider af svære skader på den klare lag foran i øjet (hornhinden), kan phosphater i meget sjældne tilfælde forårsage uklare pletter på hornhinden, som skyldes at der ophobes calcium i løbet af behandlingen.
3. Sådan skal du bruge AKANTIOR
Brug altid lægemidlet nøjagtigt efter lægens anvisning. Er du i tvivl, så spørg lægen.
Behandlingen består af to dele: intensiv behandling i de første 19 dage og fortsat behandling fra dag 20.
Den anbefalede dosis er 1 dråbe AKANTIOR i det berørte øje som følger:
Start af intensiv behandling (19 dage)
- Påfør en dråbe hver time (16 gange om dagen) i løbet af de første fem dage (dag 1 til 5)
- Påfør en dråbe hver 2. time (8 gange om dagen) i løbet af de næste syv dage (dag 6 til 12)
- Påfør en dråbe hver 3. time (6 gange om dagen) i løbet af de næste syv dage (dag 13 til 19)
Fortsat behandling
- Påfør en dråbe hver 4. time (4 gange om dagen) indtil du ikke længere har hornhindebetændelse eller tegn på infektion (du er helbredt).
Lægen vil rådgive dig om, hvornår du skal stoppe behandlingen.
Brugsanvisning
- Vask hænderne.
- Åbn aluminiumsbrevet med enkeltdosisbeholderne.
- Enkeltdosisbeholderen tages ud af dens strip og de uåbnede beholdere lægges tilbage i brevet.
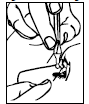
- Åbn enkeltdosisbeholderen ved at dreje den øverste del uden at trække. Rør ikke ved spidsen efter åbning af beholderen.
- Bøj hovedet bagover. Enkeltdosisbeholderen er nu åben. Hold enkeltdosisbeholderen lodret, og tryk ikke på den.
- Brug din finger til forsigtigt at trække det nederste øjenlåg på dit berørte øje ned.
- Vend enkeltdosisbeholderen på hovedet, og placer spidsen af beholderen tæt på øjet. Berør ikke øjet eller øjenlåget med spidsen på beholderen.
- Tryk på enkeltdosisbeholderen så du kun administrerer én dråbe, og slip derefter det nederste øjenlåg.
- Luk øjet og tryk en finger mod hjørnet af det berørte øje ved siden af næsen. Hold i 2 minutter.
- Bortskaf enkeltdosisbeholderen efter brug.
Hvis du har brugt for meget AKANTIOR
Påfør din næste dosis i på det sædvanlige tidspunkt, da det sandsynligvis ikke vil forårsage alvorlig skade.
Hvis du har glemt at bruge AKANTIOR
Påfør din næste dosis som sædvanligt. Du må ikke bruge en dobbeltdosis som erstatning for den glemte dosis.
Hvis du holder op med at bruge AKANTIOR
Brug AKANTIOR som foreskrevet for at opnå den bedste virkning. Fortæl det altid til lægen, hvis du overvejer at stoppe behandlingen.
Spørg lægen eller apotekspersonalet, hvis der er noget, du er i tvivl om.
4. Bivirkninger
Dette lægemiddel kan som alle andre lægemidler give bivirkninger, men ikke alle får bivirkninger. De fleste bivirkninger forekommer generelt ved det behandlede øje.
Kontakt lægen, hvis du får en svær øjenreaktion.
De følgende bivirkninger er blevet rapporteret:
Meget almindelig (kan forekomme hos flere end 1 ud af 10 personer)
- øjensmerter
- okulær hyperæmi (øjenrødme)
Almindelig (kan forekomme hos op til 1 ud af 10 personer)
- hornhindeperforering (beskadigelse af hornhindeoverfladen)
- synsnedsættelse
- ulcerøs keratitis (betændelse eller infektion i hornhinden)
- hornhindepiteldefekter (defekter i det yderste hornhindelag)
- hornhindeinfiltrater (immunrespons på hornhindeskade)
- punktat keratitis (små huller i øjets overflade)
- tåreflåd (øjne, der løber i vand)
- konjunktival hyperæmi (rødme i bindehinden)
- øjenbetændelse
- øjenirritation
- fotofobi (ubehagelig lysfølsomhed i øjet)
- konjunktival papillae (indersiden af øjenlåget bliver rødt, hævet og irriteret)
- øjenpruritus (kløende øjne)
- øjenflåd
- hævede øjne
- fornemmelse af fremmedlegeme i øjet
- ubehag i øjet
- tørre øjne
- konjunktivitis (betændelse i det yderste lag af øjet)
- øjeninfektion
- forværret tilstand (sygdomsforværring)
- præparatintolerans (overfølsomhed over for lægemidlet)
- reaktioner på påføringsstedet, såsom smerter
- reaktioner på påføringsstedet, såsom ubehag
- reaktioner på påføringsstedet, såsom pruritus (kløe)
- vedvarende epiteldefekt (vedvarende tab af yderste hornhindelag efter skade)
- toksicitet over for forskellige midler
- påkrævet hornhindetransplantation
Indberetning af bivirkninger
Hvis du oplever bivirkninger, bør du tale med din læge eller apotekspersonalet. Dette gælder også mulige bivirkninger, som ikke er medtaget i denne indlægsseddel. Du eller dine pårørende kan også indberette bivirkninger direkte til Lægemiddelstyrelsen via:
Lægemiddelstyrelsen
Axel Heides Gade 1
DK-2300 København S
Websted: www.meldenbivirkning.dk.
Ved at indrapportere bivirkninger kan du hjælpe med at fremskaffe mere information om sikkerheden af dette lægemiddel.
5. Opbevaring
Opbevar lægemidlet utilgængeligt for børn.
Brug ikke lægemidlet efter den udløbsdato, der står på pakningen efter Exp. Udløbsdatoen er den sidste dag i den pågældende måned for det uåbnede præparat.
Dette lægemiddel kræver ingen særlige forholdsregler vedrørende opbevaringen.
Efter anbrud af brevet skal enkeltdosisbeholderne anvendes inden for 28 dage. Efter denne periode skal de ubrugte enkeltdosisbeholdere bortskaffes.
Indholdet af enkeltdosisbeholderen skal anvendes umiddelbart efter åbning og eventuelt restindhold skal bortskaffes.
Spørg apotekspersonalet, hvordan du skal bortskaffe lægemiddelrester. Af hensyn til miljøet må du ikke smide lægemiddelrester i afløbet, toilettet eller skraldespanden.
6. Pakningsstørrelser og yderligere oplysninger
AKANTIOR indeholder:
- Aktivt stof: polihexanid. Hver ml opløsning indeholder 0,8 mg polihexanid.
- Øvrige indholdsstoffer: natriumdihydrogenphosphatmonohydrat, dinatriumphosphatdodecahydrat, natriumchlorid og renset vand.
AKANTIOR indeholder phosphater (se punkt 2).
Udseende og pakningsstørrelser
AKANTIOR øjendråber, opløsning i enkeltdosisbeholder (øjendråber) er en klar og farveløs opløsning i en enkeltdosisbeholder.
Enkeltdosisbeholderne er indsat i forseglede strips med 5 enheder, som igen er pakket i et brev af polyester/aluminium/polyethylen, som er pakket i en kartonæske.
Pakningsstørrelser:
- 20 enkeltdosisbeholdere
- 30 enkeltdosisbeholdere
- multipakning indeholdende 120 (4 pakninger med 30) enkeltdosisbeholdere.
Ikke alle pakningsstørrelser er ikke nødvendigvis markedsført.
Indehaver af markedsføringstilladelsen og fremstiller
SIFI S.p.A.
Via Ercole Patti, 36
95025 Aci Sant'Antonio (CT) Italien
Du kan finde yderligere oplysninger om dette lægemiddel på Det Europæiske Lægemiddelagenturs hjemmeside http://www.ema.europa.eu.
Du kan også finde detaljerede og opdaterede oplysninger om dette lægemiddel ved at scanne den QR-kode, der er angivet i indlægssedlen eller på den ydre æske, ved brug af en smartphone/udstyr. De samme oplysninger kan også ses på den følgende URL: https://qr.sifigroup.com/akantior/
Revisionsdato
Denne indlægsseddel blev senest ændret 08/2024