Eylea
injektionsvæske, opløsning i fyldt injektionssprøjte 40 mg/ml
Bayer
Indledning - VOKSNE
Indlægsseddel: Information til den voksne patient
Eylea 40 mg/ml injektionsvæske, opløsning, i en fyldt injektionssprøjte
aflibercept
VOKSNE
|
Se informationen til forældre/værger til for tidligt fødte spædbørn på den anden side af denne indlægsseddel [relevant for 1 sprog].
|
Læs denne indlægsseddel grundigt, inden du begynder at få dette lægemiddel, da den indeholder vigtige oplysninger.
- Gem indlægssedlen. Du kan få brug for at læse den igen.
- Spørg lægen, hvis der er mere, du vil vide.
- Kontakt lægen, hvis du får bivirkninger, herunder bivirkninger, som ikke er nævnt i denne indlægsseddel. Se punkt 4.
Se den nyeste indlægsseddel på www.indlaegsseddel.dk.
Oversigt over indlægssedlen
- Virkning og anvendelse
- Det skal du vide, før du begynder at få Eylea
- Sådan vil du få Eylea
- Bivirkninger
- Opbevaring
- Pakningsstørrelser og yderligere oplysninger
1. Virkning og anvendelse
Eylea er en opløsning, der indsprøjtes i øjet for at behandle øjensygdomme hos voksne, som kaldes
- neovaskulær (våd) aldersrelateret makulær degeneration hos voksne (våd AMD),
- nedsat syn på grund af makulaødem sekundært til retinal veneokklusion (grenveneokklusion (BRVO) eller centralveneokklusion (CRVO)),
- nedsat syn på grund af diabetisk makulaødem (DME),
- nedsat syn på grund af myopisk koroidal neovaskularisering (myopisk CNV).
Aflibercept, det aktive stof i Eylea, blokerer for aktiviteten af en gruppe faktorer, der kaldes vaskulær endotelial vækstfaktor A (VEGF-A) og placenta-vækstfaktor (PIGF).
Hos patienter med våd AMD og myopisk CNV er disse vækstfaktorer involveret i den unormale dannelse af nye blodkar i øjet, hvis der er overskud af dem. Disse nye blodkar kan medføre, at der lækkes bestanddele fra blodet ind i øjet, og dette kan evt. beskadige det væv i øjet, der gør dig i stand til at se.
Hos patienter med CRVO sker der en blokering i det største blodkar, som transporterer blod væk fra nethinden. VEGF-niveauerne stiger som en reaktion på dette og forårsager udsivning af væske i nethinden, hvilket medfører hævelse af makula (den del af nethinden, der er ansvarlig for, at vi kan opfatte fine detaljer). Dette kaldes et makulaødem. Når makula er hævet på grund af væske, bliver det centrale syn sløret.
Hos patienter med BRVO er en eller flere grene af det store blodkar, der transporterer blod væk fra nethinden, blokeret. VEGF-niveauerne stiger som en reaktion på dette og forårsager en udsivning af væske i nethinden, hvilket fører til makulaødem.
Diabetisk makulaødem er en hævelse af nethinden, der forekommer hos patienter med sukkersyge på grund af, at blodkarrene i den gule plet (makula) lækker væske. Makula er den del af nethinden, der er ansvarlig for det skarpe syn. Når makula hæver på grund af væske, bliver det centrale syn sløret.
Eylea har vist sig at stoppe væksten af nye unormale blodkar i øjet, der ofte lækker væske eller bløder. Eylea kan hjælpe med at stabilisere og i mange tilfælde forbedre det synstab, der er relateret til våd AMD, CRVO, BRVO, DME og myopisk CNV.
2. Det skal du vide, før du begynder at få Eylea
Du vil ikke få Eylea
- hvis du er allergisk over for aflibercept eller et af de øvrige indholdsstoffer i Eylea (angivet i punkt 6).
- hvis du har en aktiv eller formodet infektion i eller rundt om øjet (okulær eller periokulær infektion).
- hvis du har en alvorlig øjenbetændelse (indikeret ved smerter eller rødmen).
Advarsler og forsigtighedsregler
Kontakt lægen, før du får Eylea
- Hvis du har grøn stær.
- Hvis du tidligere har set blinkende lys eller "flyvende fluer", og hvis de "flyvende fluer" pludselig øger i antal eller bliver større.
- Hvis du er blevet opereret, eller der planlægges operation i dit øje i de sidste eller næste fire uger.
- Hvis du har en alvorlig form for CRVO eller BRVO (iskæmisk CRVO eller BRVO), anbefales behandling med Eylea ikke.
Desuden er det vigtigt for dig at vide, at
- Eyleas sikkerhed og virkning ved administration i begge øjne samtidigt ikke er blevet undersøgt, og kan, hvis det anvendes på denne måde, øge risikoen for bivirkninger.
- Injektioner med Eylea kan medføre et øget tryk i øjet (intraokulært tryk) hos nogle patienter inden for 60 minutter efter injektionen. Dette vil blive kontrolleret efter hver injektion.
- Hvis du får betændelse eller inflammation (betændelseslignende tilstand) inden i øjet (endoftalmitis), eller du får andre komplikationer, kan du få øjensmerter, øget ubehag, forværring af øjenrødme, sløret eller nedsat syn og øget lysfølsomhed. Det er vigtigt, at få alle symptomer diagnosticeret og behandlet hurtigst muligt.
- Din øjenlæge vil undersøge, om du har andre risikofaktorer, der kan øge risikoen for rifter i eller løsning af et af lagene bagest i øjet (løsning af eller rift i nethinden eller nethinde-pigment-epitelet). I disse tilfælde skal Eylea gives med forsigtighed.
- Eylea bør ikke anvendes under graviditeten, medmindre den potentielle fordel opvejer den potentielle risiko for det ufødte barn
- Kvinder i den fertile alder skal anvende sikker kontraception under behandlingen og i mindst 3 måneder efter den sidste injektion af Eylea.
Brug af VEGF-hæmmere, stoffer, der ligner det stof, der findes i Eylea, i kroppen (systemisk brug), er muligvis forbundet med risiko for blodpropper (arterielle tromboemboliske bivirkninger), hvilket kan føre til hjerteanfald eller slagtilfælde. Der er en teoretisk risiko for sådanne hændelser, efter at Eylea er blevet indsprøjtet i øjet. Der er begrænsede data for sikkerhed ved behandling af patienter med CRVO, BRVO, DME og myopisk CNV med tidligere slagtilfælde eller mini-slagtilfælde (transitorisk iskæmisk anfald) eller hjerteanfald inden for de sidste 6 måneder. Hvis noget af dette gælder for dig, vil du med stor forsigtighed blive behandlet med Eylea.
Der er kun begrænset erfaring ved behandling af
- patienter med DME, der skyldes type I-sukkersyge.
- sukkersygepatienter med meget højt gennemsnitligt blodsukker (HbA1c over 12 %).
- sukkersygepatienter med en øjensygdom forårsaget af sukkersyge, der kaldes proliferativ diabetisk retinopati.
Der er ingen erfaring ved behandling af
- patienter med akutte infektioner.
- patienter med andre øjensygdomme, såsom løsning af nethinden eller et hul i makula.
- sukkersygepatienter med ukontrolleret højt blodtryk.
- ikke-asiatiske patienter med myopisk CNV.
- patienter, der tidligere er blevet behandlet for myopisk CNV.
- patienter med skader uden for den centrale del af makula (ekstrafoveale læsioner) for myopisk CNV.
Hvis noget af det ovenstående gælder for dig, kan øjenlægen overveje behandling med Eylea på trods af den manglende erfaring.
Børn og unge
Anvendelsen af Eylea til børn og unge under 18 år for andre indikationer end præmaturitets-retinopati (ROP) er ikke blevet undersøgt.
Brug af anden medicin sammen med Eylea
Fortæl altid øjenlægen, hvis du bruger anden medicin, for nylig har brugt anden medicin eller planlægger at bruge anden medicin
Graviditet og amning
- Kvinder i den fertile alder skal anvende sikker prævention under behandlingen og i mindst 3 måneder efter den sidste injektion af Eylea.
- Der er ingen erfaring med at bruge Eylea til gravide kvinder. Eylea bør ikke anvendes under graviditeten, medmindre den potentielle fordel opvejer den potentielle risiko for det ufødte barn. Hvis du er gravid eller planlægger at blive gravid, skal du diskutere dette med din øjenlæge inden behandlingen med Eylea.
- Små mængder af Eylea kan udskilles i modermælk. Virkningen på ammede nyfødte/spædbørn som bliver ammet er ukendt. Eylea bør ikke anvendes undersamtidig med amning. Hvis du er en kvinde, der ammer, skal du diskutere dette med lægen inden behandlingen med Eylea.
Trafik- og arbejdssikkerhed
Efter din injektion med Eylea kan du opleve nogle midlertidige synsforstyrrelser. Du må ikke føre motorkøretøj eller betjene maskiner, så længe disse synsforstyrrelser varer ved.
Eylea indeholder
- mindre end 1 mmol (23 mg) natrium pr. dosisenhed, dvs. det er i det væsentlige natriumfrit.
- 0,015 mg polysorbat 20 pr. 0,05 ml dosis, svarende til 0,3 mg/ml. Polysorbater kan forårsage allergiske reaktioner. Kontakt din læge, hvis du har nogen kendte allergier.
3. Sådan skal du tage præparatet
En øjenlæge med erfaring i at give øjeninjektioner vil indsprøjte Eylea i dit øje under aseptiske (rene og sterile) forhold.
Den anbefalede dosis er 2 mg aflibercept (0,05 ml).
Eylea gives som en injektion i øjet (intravitreal injektion).
Før injektionen vil din øjenlæge anvende et desinficerende øjenbad, så dit øje bliver renset grundigt, for at forebygge en infektion. Din øjenlæge vil også give dig et lokalbedøvende middel for at reducere eller forhindre smerter, som du kan opleve under injektionen.
Våd AMD
Patienter med våd AMD vil blive behandlet med én injektion om måneden i tre på hinanden følgende måneder, efterfulgt af én injektion efter yderligere to måneder.
Din øjenlæge vil beslutte om behandlingsintervallet mellem injektionerne skal forblive på to måneder eller gradvist forlænges med 2- eller 4-ugers tillægsperioder, hvis din tilstand er stabil. Hvis din tilstand forværres, kan intervallet mellem injektionerne forkortes.
Medmindre der opstår problemer, eller du får anden besked af din øjenlæge, er det ikke nødvendigt, at du bliver undersøgt af øjenlægen mellem injektionerne.
Makulaødem sekundært til RVO (grenveneokklusion eller centralveneokklusion)
Din øjenlæge vil fastlægge en behandlingsplan, der passer til dig. Din behandling starter med en række månedlige Eylea-injektioner.
Afstanden mellem to injektioner bør ikke være kortere end én måned.
Øjenlægen kan beslutte at stoppe behandlingen med Eylea, hvis du ikke har nogen gavn af fortsat behandling.
Behandlingen vil fortsætte med en injektion én gang om måneden, indtil din tilstand er stabil. Det kan være nødvendigt at give 3 eller flere injektioner.
Øjenlægen overvåger, hvordan du reagerer på behandlingen. For at bevare en stabil tilstand kan øjenlægen fortsætte behandlingen ved gradvist at øge tiden mellem injektionerne. Hvis din tilstand begynder at bliver forværret, når intervallet mellem behandlingerne øges, vil øjenlægen afkorte intervallet derefter.
Afhængigt af hvordan du reagerer på behandlingen, fastlægger din øjenlæge en plan for efterfølgende undersøgelser og behandlinger.
Diabetisk makulaødem (DME)
Patienter med DME vil blive behandlet med én injektion om måneden i de første fem på hinanden følgende måneder, efterfulgt af én injektion hver anden måned.
Behandlingsintervallet fastholdes på to måneder eller justeres efter behov baseret på øjenlægens undersøgelse. Din øjenlæge vil bestemme forløbet af de opfølgende undersøgelser.
Øjenlægen kan vælge at stoppe med behandlingen med Eylea, hvis det viser sig, at du ikke har gavn af fortsat behandling.
Myopisk CNV
Patienter med myopisk CNV vil blive behandlet med en enkelt injektion. Du vil kun få flere injektioner, hvis de undersøgelser, din øjenlæge foretager, viser, at din sygdom ikke er blevet bedre.
Intervallet mellem to injektioner bør ikke være kortere end én måned.
Hvis din sygdom forsvinder og igen vender tilbage, kan din øjenlæge genstarte behandlingen.
Din øjenlæge vil fastlægge en plan for opfølgende undersøgelser.
En detaljeret brugsanvisning kan ses sidst i indlægssedlen under "Sådan forberedes og administreres Eylea til voksne".
Hvis en dosis af Eylea springes over
Aftal et nyt besøg for undersøgelse og injektion.
Hvis du holder op med Eylea-behandlingen
Kontakt øjenlægen, før du holder op med behandlingen.
Spørg øjenlægen, hvis der er noget, du er i tvivl om, om anvendelsen af dette lægemiddel.
4. Bivirkninger
Dette lægemiddel kan som alle andre lægemidler give bivirkninger, men ikke alle får bivirkninger.
Der kan muligvis forekomme allergiske reaktioner (overfølsomhed). Disse kan være alvorlige og kræve, at du kontakter lægen øjeblikkeligt.
I forbindelse med injektion af Eylea kan der på grund af injektionsproceduren optræde nogle bivirkninger, der påvirker øjnene. Nogle af disse kan være alvorlige, herunder blindhed, en alvorlig infektion eller betændelse i øjet (endoftalmitis), løsning af nethinden eller rift eller blødning i nethinden (det lysfølsomme lag bag i øjet (nethindeløsning eller rift i nethinden)), uklarhed i linsen (katarakt), blødning i øjet (blødning i glaslegemet), løsning af den geléagtige substans i øjet fra nethinden (glaslegemeløsning) og stigning i trykket i øjet, se punkt 2. Disse alvorlige bivirkninger, der påvirker øjnene, forekom ved færre end 1 ud af 1.900 injektioner i kliniske studier.
Hvis du oplever pludseligt nedsat syn eller øget smerte og rødme i øjet efter din injektion, skal du kontakte lægen øjeblikkeligt.
Liste over bivirkninger
Følgende er en liste over de bivirkninger, der er indberettet som værende muligvis relaterede til injektionsproceduren eller medicinen. Bliv ikke bekymret; det er ikke sikkert, at du får nogen af disse bivirkninger. Tal altid med din læge, hvis du har mistanke om eventuelle bivirkninger.
Meget almindelige bivirkninger (kan forekomme hos mere end 1 ud af 10 behandlede):
- forringet syn
- blødning bagerst i øjet (retinalblødning)
- blodskudt øje på grund af blødning fra de små blodkar i øjets ydre lag (konjunktivalblødning)
- øjensmerter
Almindelige bivirkninger (kan forekomme hos op til 1 ud af 10 behandlede):
- løsning af eller rift i et af lagene bag i øjet, hvilket giver lysglimt, der bevæger sig som flyvende fluer og nogle gange udvikler sig til synstab (løsning eller rift i det retinale-pigment-epitel*/nethindeløsning/rift)
- * Rift i det retinale-pigment-epitel er forbundet med våd AMD; kun observeret hos patienter med våd AMD.
- nedbrydning af nethinden (medfører synsforstyrrelser)
- blødning i øjet (blødning i glaslegemet)
- visse former for uklarhed af linsen (katarakt)
- beskadigelse af øjeæblets yderste lag (hornhinden)
- stigning af trykket inden i øjet
- små pletter i synsfeltet ("flyvende fluer")
- løsning af den geléagtige substans inde i øjet fra nethinden (glaslegemeløsning, hvilket medfører lysglimt/og eller flyvende fluer)
- en følelse af at have noget i øjet
- øget tåredannelse
- hævelse af øjenlåget
- blødning på injektionsstedet
- rødt øje
Ikke almindelige bivirkninger (kan forekomme hos op til 1 ud af 100 behandlede):
- allergiske reaktioner (overfølsomhed)**
- ** Der blev set allergiske reaktioner såsom udslæt, kløe (pruritus), nældefeber (urticaria) og få tilfælde af alvorlige allergiske reaktioner (anafylaktiske/anafylaktoide reaktioner).
- alvorlig inflammation (betændelseslignende reaktion) eller betændelse inden i øjet (endoftalmitis)
- betændelse i regnbuehinden eller andre dele af øjet (iritis, uveitis, iridocyklitis, reaktion i forreste kammer)
- unormal fornemmelse i øjet
- irritation af øjenlåget
- hævelse af øjeæblets yderste lag (hornhinden)
Sjældne bivirkninger (kan forekomme hos op til 1 ud af 1.000 behandlede):
- blindhed
- uklarhed i linsen på grund af en skade (traumatisk katarakt)
- inflammation (betændelseslignende reaktion) i den geléagtige substans inden i øjet
- pus i øjet
Ikke kendt (hyppigheden kan ikke estimeres ud fra forhåndenværende data):
- betændelse i den hvide del af øjet forbundet med rødme og smerte (skleritis)
I kliniske studier var der en øget forekomst af blødning fra de små blodkar i de ydre lag af øjet (konjunktival blødning) hos patienter med våd AMD, der fik blodfortyndende medicin. Den øgede forekomst var sammenlignelig mellem patienter behandlet med ranibizuman og Eylea.
Brug af VEGF-hæmmere, stoffer, der ligner det stof, der findes i Eylea, i kroppen (systemisk brug) er muligvis forbundet med risiko for blodpropper, der blokerer blodkar (arterielle trombotiske bivirkninger), hvilket kan medføre hjerteslag eller slagtilfælde. Der er en teoretisk risiko for sådanne hændelser efter injektion af Eylea i øjet.
Som med alle proteiner, der anvendes i behandlingsøjemed, er der en mulighed for en immunreaktion (dannelse af antistoffer) ved anvendelse af Eylea.
Indberetning af bivirkninger
Hvis du oplever bivirkninger, bør du tale med din læge. Dette gælder også mulige bivirkninger, som ikke er medtaget i denne indlægsseddel. Du eller dine pårørende kan også indberette bivirkninger direkte til Lægemiddelstyrelsen via:
Lægemiddelstyrelsen
Axel Heides Gade 1
DK-2300 København S
Websted: www.meldenbivirkning.dk
Ved at indrapportere bivirkninger kan du hjælpe med at fremskaffe mere information om sikkerheden af dette lægemiddel.
5. Opbevaring
- Opbevar lægemidlet utilgængeligt for børn.
- Brug ikke lægemidlet efter den udløbsdato, der står på etiketten og æsken efter EXP. Udløbsdatoen er den sidste dag i den nævnte måned.
- Opbevares i køleskab (2 °C - 8 °C). Må ikke nedfryses.
- Den uåbnede blister kan opbevares uden for køleskab ved temperaturer under 25 °C i op til 24 timer.
- Opbevares i den originale emballage for at beskytte mod lys.
- Spørg apotekspersonalet, hvordan du skal bortskaffe medicinrester. Af hensyn til miljøet må du ikke smide medicinrester i afløbet eller skraldespanden.
6. Pakningsstørrelser og yderligere oplysninger
Eylea indeholder:
- Aktivt stof: aflibercept. En fyldt injektionssprøjte indeholder et ekstraherbart volumen på mindst 0,09 ml svarende til mindst 3,6 mg aflibercept. En fyldt injektionssprøjte giver en dosis på 2 mg aflibercept i 0,05 ml.
- Øvrige indholdsstoffer: polysorbat 20 (E 432), natriumdihydrogenphosphatmonohydrat (til justering af pH), dinatriumhydrogenphosphatheptahydrat (til justering af pH), natriumchlorid, saccharose, vand til injektionsvæsker.
Se ’Eylea indeholder’ i punkt 2 for flere oplysninger.
Udseende og pakningsstørrelser
Eylea er en injektionsvæske, opløsning (injektion) i en fyldt injektionssprøjte. Opløsningen er farveløs til let gul.
Pakningsstørrelse 1 stk. fyldt injektionssprøjte.
Indehaver af markedsføringstilladelsen og fremstiller
Indehaver af markedsføringstilladelsen
Bayer AG
51368 Leverkusen
Tyskland
Fremstiller
Bayer AG
Müllerstraße 178
13353 Berlin
Tyskland
Hvis du ønsker yderligere oplysninger om dette lægemiddel, skal du henvende dig til den lokale repræsentant for indehaveren af markedsføringstilladelsen:
Danmark
Bayer A/S
Tlf: +45-45 235 000
Andre informationskilder
Du kan finde yderligere oplysninger om dette lægemiddel på Det Europæiske Lægemiddelagenturs hjemmeside https://www.ema.europa.eu.
Skan her for at se hjemmesiden med lokal information: https://www.pi.bayer.com/eylea1.
QR-koden med link til indlægssedlen er inkluderet.
Oplysninger tiltænkt læger og sundhedspersonale
Sådan forberedes og administreres Eylea til voksne
Den fyldte injektionssprøjte må kun anvendes til behandling af et enkelt øje.
Det sterile fyldte blisterkort med injektionssprøjte må ikke åbnes uden for det rene rum, hvor administrationen finder sted.
Den fyldte injektionssprøjte indeholder mere end den anbefalede dosis på 2 mg aflibercept (svarende til 0,05 ml). Det overskydende volumen skal kasseres inden administration.
Før injektion skal injektionsvæsken inspiceres visuelt for fremmedlegemer, misfarvning eller enhver forandring i det fysiske udseende. Produktet bortskaffes, hvis en af disse observeres.
Den uåbnede blister kan opbevares uden for køleskab ved temperaturer under 25 °C i op til 24 timer. Efter at blisteren er åbnet, fortsættes proceduren under aseptiske betingelser.
Der skal bruges en 30 G x ½"-kanyle til intravitreal injektion.
Brugsanvisning til fyldt injektionssprøjte:
1. Når du er klar til at administrere Eylea, åbner du æsken, og fjerner den steriliserede blister. Blisteren åbnes forsigtigt, så indholdet forbliver sterilt. Opbevar injektionssprøjten på den sterile bakke, indtil du er klar til at samle den.
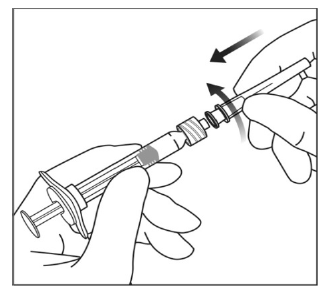
2. Injektionssprøjten fjernes fra den steriliserede blister ved at bruge en aseptisk teknik.
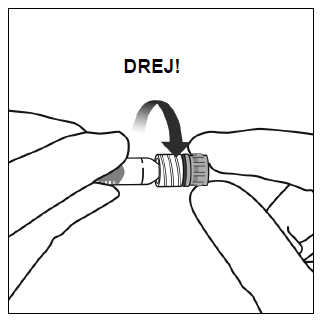
3. Hold injektionssprøjten i én hånd for at fjerne låget på injektionssprøjten, mens den anden hånd bruges til at gribe fat i låget på injektionssprøjten med tommel- og pegefinger. Bemærk: Du skal dreje låget på injektionssprøjten af (må ikke brækkes).
4. For at bibeholde produktets sterilitet må stemplet ikke trækkes tilbage.
5. Med en aseptisk teknik drejes kanylen godt fast på spidsen af Luer-lock-injektionssprøjten.
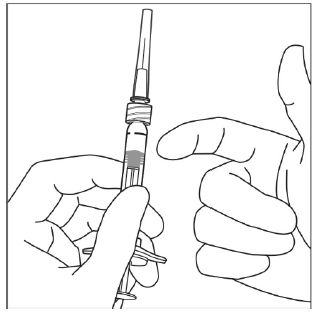
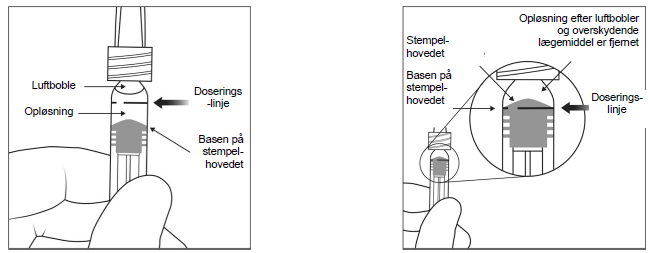
6. Kontroller, om det er bobler i injektionssprøjten, ved at holde injektionssprøjten med kanylen pegende opad. Hvis der er bobler, banker du let på injektionssprøjten med fingeren, indtil boblerne stiger opad.
7. Fjern alle bobler og sprøjt overskydende lægemiddel ud ved langsomt at trykke stemplet ned, så basen på stempelhovedet (ikke spidsen af stempelhovedet) er på linje med doseringslinjen på injektionssprøjten (svarer til 0,05 ml, dvs. 2 mg aflibercept).
Bemærk: Denne præcise placering af stemplet er meget vigtig, da en ukorrekt placering af stemplet kan føre til injektion af mere eller mindre opløsning end den anbefalede dosis.
8. Injicér samtidig med at stemplet forsigtigt presses ned og med konstant tryk. Pres ikke yderligere, når stemplet rammer bunden af injektionssprøjten. Benyt ikke den resterende opløsning, som kan ses i injektionssprøjten.
9. Den fyldte injektionssprøjte er kun til engangsbrug. Ekstraktion af flere doser fra én fyldt injektionssprøjte kan øge risikoen for kontaminering og efterfølgende infektion.
Ikke anvendt lægemiddel samt affald heraf skal bortskaffes i henhold til lokale retningslinjer.
Indledning - FOR TIDLIGT FØDTE SPÆDBØRN
Indlægsseddel: Information til forældre/værger for for tidligt fødte spædbørn
Eylea 40 mg/ml injektionsvæske, opløsning, i en fyldt injektionssprøjte
aflibercept
FOR TIDLIGT FØDTE SPÆDBØRN
|
Se informationen til voksne på den anden side af denne indlægsseddel [relevant for 1 sprog]. |
Læs denne indlægsseddel grundigt, inden spædbarnet begynder at få dette lægemiddel, da den indeholder vigtige oplysninger.
- Gem indlægssedlen. Du kan få brug for at læse den igen.
- Spørg spædbarnets læge, hvis der er mere, du vil vide.
- Kontakt spædbarnets læge, hvis du bemærker symptomer på bivirkninger, herunder mulige symptomer og bivirkninger, som ikke er nævnt i denne indlægsseddel. Se punkt 4.
Se den nyeste indlægsseddel på www.indlaegsseddel.dk.
Oversigt over indlægssedlen
- Virkning og anvendelse
- Det skal du vide, før spædbarnet begynder at få Eylea
- Sådan får spædbarnet Eylea
- Bivirkninger
- Opbevaring
- Pakningsstørrelser og yderligere oplysninger
1. Virkning og anvendelse
Eylea er en opløsning, der sprøjtes ind i øjet. Eylea tilhører en gruppe lægemidler, der kaldes antineovaskulariseringsstoffer. Det indeholder det aktive stof, der kaldes aflibercept.
Eylea anvendes til for tidligt fødte spædbørn til at behandle en øjensygdom, der kaldes præmaturitets-retinopati (ROP). Spædbørn med ROP har unormal vækst af nye blodkar bagest i øjet (nethinden) induceret af vaskulær endotelial vækstfaktor (VEGF). Dette kan forårsage synsnedsættelse og i svære tilfælde permanent blindhed.
Aflibercept, det aktive stof i Eylea, blokerer for aktiviteten af en gruppe faktorer, der kaldes vaskulær endotelial vækstfaktor A (VEGF-A) og placental-vækstfaktor (PIGF).
Eylea har vist sig at stoppe væksten af nye unormale blodkar i øjet, der ofte lækker væske eller bløder. Eylea kan hjælpe med at stabilisere og i mange tilfælde forbedre det synstab, der er relateret til ROP.
2. Det skal du vide, før spædbarnet begynder at få Eylea
Spædbarnet vil ikke få Eylea hvis han eller hun
- er allergisk over for aflibercept eller et af de øvrige indholdsstoffer i Eylea (angivet i punkt 6).
- har en aktiv eller formodet infektion i eller rundt om øjet (okulær eller periokulær infektion).
- har alvorlig øjenbetændelse (indikeret ved smerter eller rødmen).
Advarsler og forsigtighedsregler
Kontakt spædbarnets læge, før spædbarnet får Eylea
- Hvis spædbarnet er blevet opereret indenfor de sidste 4 uger, eller der planlægges operation i spædbarnets øje indenfor de næste fire uger.
Desuden er det vigtigt for dig at vide, at
- Injektioner med Eylea kan medføre et øget tryk i øjet (intraokulært tryk) hos nogle patienter inden for 60 minutter efter injektionen. Dette vil blive kontrolleret af spædbarnets læge efter hver injektion.
- Hvis spædbarnet udvikler betændelse eller inflammation (betændelseslignende tilstand) inde i øjet (endoftalmitis), eller spædbarnet får andre komplikationer, kan spædbarnet få rødme/irritation i øjet, øjenflåd, hævede øjenlåg og øget lysfølsomhed. Det er vigtigt, at få alle symptomer diagnosticeret og behandlet hurtigst muligt.
Fortæl straks spædbarnets læge, hvis spædbarnet udvikler de beskrevne tegn eller symptomer. - Spædbarnets læge vil undersøge, om spædbarnet har andre risikofaktorer, der kan øge risikoen for en rift eller løsning af et af lagene bagest i øjet (løsning af eller rift i nethinden). I disse tilfælde skal Eylea gives med forsigtighed.
Brug af VEGF-hæmmere i kroppen (systemisk brug), stoffer der ligner det stof der findes i Eylea, er muligvis forbundet med risiko for blodpropper (arterielle tromboemboliske bivirkninger), hvilket kan føre til hjerteanfald eller slagtilfælde. Der er en teoretisk risiko for sådanne hændelser, efter at Eylea er blevet indsprøjtet i øjet.
Der er ingen erfaring ved behandling af
- patienter med akutte infektioner.
- patienter med andre øjensygdomme, såsom løsning af nethinden eller et hul i makula.
Hvis noget af det ovenstående gælder for spædbarnet, kan spædbarnets læge overveje behandling med Eylea på trods af den manglende erfaring.
Brug af anden medicin sammen med Eylea
Fortæl altid spædbarnets læge, hvis spædbarnet får anden medicin, for nylig har fået anden medicin eller planlægger at få anden medicin.
Eylea indeholder
- mindre end 1 mmol (23 mg) natrium pr. dosisenhed, dvs. det er i det væsentlige natriumfrit.
- 0,003 mg polysorbat 20 pr. 0,01 ml dosis, svarende til 0,3 mg/ml. Polysorbater kan forårsage allergiske reaktioner. Kontakt din læge, hvis dit barn har nogen kendte allergier.
3. Sådan får spædbarnet Eylea
En øjenlæge med erfaring i at give øjeninjektioner vil sprøjte Eylea ind i spædbarnets øje under aseptiske (rene og sterile) forhold.
Den anbefalede dosis er 0,4 mg aflibercept (0,01 ml).
Eylea gives som en injektion i spædbarnets øje (intravitreal injektion).
Før injektionen vil spædbarnets læge anvende et desinficerende middel, så spædbarnets øje bliver renset grundigt, for at forebygge en infektion. Spædbarnets læge vil også give spædbarnet et lokalbedøvende middel for at reducere eller forhindre smerter, som spædbarnet kan opleve under injektionen.
Behandlingen startes med en enkelt injektion pr. øje, og kan gives i det andet øje den samme dag. Spædbarnets læge vil overvåge tilstanden af spædbarnets øje/øjne. Afhængigt af hvordan spædbarnet reagerer på behandlingen, vil spædbarnets læge beslutte, om og hvornår yderligere behandling er nødvendig. Behandlingsintervallet mellem de 2 doser injiceret i det samme øje skal være mindst 4 uger.
En detaljeret brugsanvisning kan ses sidst i indlægssedlen under "Sådan forberedes og administreres Eylea til for tidligt fødte spædbørn".
Hvis spædbarnet holder op med at få Eylea
Hvis du overvejer at stoppe spædbarnets behandling med Eylea, skal du diskutere det med spædbarnets læge ved dit næste besøg. Spædbarnets læge vil rådgive dig og beslutte hvor længe spædbarnet skal behandles med Eylea.
Spørg spædbarnets læge, hvis der er noget, du er i tvivl om vedrørende anvendelsen af dette lægemiddel.
4. Bivirkninger
Dette lægemiddel kan som alle andre lægemidler give bivirkninger, men ikke alle får bivirkninger.
Bivirkninger rapporteret hos mere end ét for tidligt født spædbarn var
- løsning af laget bag i øjet (nethindeløsning)
- blødning bag i øjet (nethindeblødning)
- blodskudt øje på grund af blødning fra små blodkar i øjets ydre lag (konjunktivalblødning)
- blødning på injektionsstedet
- stigning af trykket i øjet
- hævelse af øjenlåget (øjenlågsødem)
Yderligere bivirkninger, der er blevet observeret med Eylea hos voksne er anført nedenfor. Disse bivirkninger kan også forekomme hos for tidligt fødte spædbørn
- allergiske reaktioner (overfølsomhed).
Disse kan være alvorlige og kræve, at du kontakter spædbarnets læge øjeblikkeligt.
Bivirkninger, der påvirker øjnene på grund af injektionsproceduren kan være alvorlige, herunder
- blindhed
- en alvorlig infektion eller betændelse i øjet (endoftalmitis)
- løsning af nethinden, rift eller blødning i nethinden (det lysfølsomme lag bag i øjet (nethindeløsning eller rift i nethinden)
- uklarhed i linsen (katarakt)
- blødning i øjet (blødning i glaslegemet)
- løsning af den geléagtige struktur i øjet fra nethinden (glaslegemeløsning)
- stigning i trykket i øjet (øget intraokulært tryk), se punkt 2
- Disse alvorlige bivirkninger, der påvirker øjnene, forekom ved færre end 1 ud af 1.900 injektioner i kliniske studier hos voksne.
Det er vigtigt at identificere og behandle alvorlige bivirkninger, såsom infektion inden i øjet eller nethindeløsning så hurtigt som muligt.
Fortæl det straks til spædbarnets læge, hvis du bemærker symptomer i spædbarnets øje efter injektion, såsom
- rødme/irritation
- øjenflåd
- hævede øjenlåg
- øget lysfølsomhed
Andre bivirkninger observeret hos voksne er beskrevet nedenfor.
Liste over bivirkninger
Følgende er en liste over de bivirkninger, der er indberettet som værende muligvis relaterede til injektionsproceduren eller medicinen. Bliv ikke bekymret; det er ikke sikkert, at spædbarnet får nogen af disse bivirkninger. Tal altid med spædbarnets læge, hvis du har mistanke om eventuelle bivirkninger.
Meget almindelige bivirkninger (kan forekomme hos mere end 1 ud af 10 behandlede):
- forringet syn
- blødning bagerst i øjet (nethindeblødning)
- blodskudt øje på grund af blødning fra de små blodkar i øjets ydre lag (konjunktivalblødning)
- øjensmerter
Almindelige bivirkninger (kan forekomme hos op til 1 ud af 10 behandlede):
- løsning af eller rift i et af lagene bag i øjet, hvilket giver lysglimt, der bevæger sig som flyvende fluer og nogle gange udvikler sig til synstab (løsning eller rift i det retinale pigment-epitel* eller nethindeløsning/rift)
- * Rift i nethinde-pigment-epitelet vides at være forbundet med våd AMD; kun observeret hos patienter med våd AMD.
- funktionstab af nethinden (medfører synsforstyrrelser)
- blødning i øjet (blødning i glaslegemet)
- flere former for uklarhed af linsen (katarakt)
- beskadigelse af øjeæblets yderste lag (hornhinden)
- stigning af trykket inden i øjet
- små pletter i synsfeltet ("flyvende fluer")
- løsning af den geléagtige struktur inde i øjet fra nethinden (glaslegemeløsning, hvilket medfører lysglimt/og eller flyvende fluer)
- fremmedlegemefornemmelse (en følelse af at have noget i øjet)
- øget tåredannelse
- hævelse af øjenlåget
- blødning på injektionsstedet
- rødt øje
Ikke almindelige bivirkninger (kan forekomme hos op til 1 ud af 100 behandlede):
- allergiske reaktioner (overfølsomhed)**
- ** Der blev set allergiske reaktioner såsom udslæt, kløe (pruritus), nældefeber (urticaria) og få tilfælde af alvorlige allergiske reaktioner (anafylaktiske/anafylaktoide reaktioner).
- alvorlig inflammation (betændelseslignende reaktion) eller betændelse inden i øjet (endoftalmitis)
- betændelse i regnbuehinden eller andre dele af øjet (iritis, uveitis, iridocyklitis, reaktion i forreste kammer)
- unormal fornemmelse i øjet
- irritation af øjenlåget
- hævelse af øjeæblets yderste lag (hornhinden)
Sjældne bivirkninger (kan forekomme hos op til 1 ud af 1.000 behandlede):
- blindhed
- uklarhed i linsen på grund af en skade (traumatisk katarakt)
- inflammation (betændelseslignende reaktion) i den geléagtige struktur inden i øjet
- pus i øjet
Ikke kendt (hyppigheden kan ikke estimeres ud fra forhåndenværende data):
- betændelse i den hvide del af øjet forbundet med rødme og smerte (skleritis)
Brug af VEGF-hæmmere i kroppen (systemisk brug), stoffer der ligner det stof der findes i Eylea, er muligvis forbundet med risiko for blodpropper, der blokerer blodkar (arterielle trombotiske bivirkninger), hvilket kan medføre hjerteslag eller slagtilfælde. Der er en teoretisk risiko for sådanne hændelser efter injektion af Eylea i øjet.
Som med alle proteiner, der anvendes i behandlingsøjemed, er der en mulighed for en immunreaktion (dannelse af antistoffer) ved anvendelse af Eylea.
Hvis du har spørgsmål om bivirkninger, bedes du spørge spædbarnets læge.
Indberetning af bivirkninger
Hvis du observerer bivirkninger, bør du tale med spædbarnets læge. Dette gælder også mulige bivirkninger, som ikke er medtaget i denne indlægsseddel. Du eller dine pårørende kan også indberette bivirkninger direkte til Lægemiddelstyrelsen via:
Lægemiddelstyrelsen
Axel Heides Gade 1
DK-2300 København S
Websted: www.meldenbivirkning.dk
Ved at indrapportere bivirkninger kan du hjælpe med at fremskaffe mere information om sikkerheden af dette lægemiddel.
5. Opbevaring
- Opbevar lægemidlet utilgængeligt for børn.
- Brug ikke lægemidlet efter den udløbsdato, der står på etiketten og æsken efter EXP. Udløbsdatoen er den sidste dag i den nævnte måned.
- Opbevares i køleskab (2 °C - 8 °C). Må ikke nedfryses.
- Den uåbnede blister kan opbevares uden for køleskab ved temperaturer under 25 °C i op til 24 timer.
- Opbevares i den originale emballage for at beskytte mod lys.
- Spørg apotekspersonalet, hvordan du skal bortskaffe medicinrester. Af hensyn til miljøet må du ikke smide medicinrester i afløbet eller skraldespanden.
6. Pakningsstørrelser og yderligere oplysninger
Eylea indeholder:
- Aktivt stof: aflibercept. En fyldt injektionssprøjte indeholder et ekstraherbart volumen på mindst 0,09 ml svarende til mindst 3,6 mg aflibercept. En fyldt injektionssprøjte giver en enkelt dosis på 0,4 mg aflibercept i 0,01 ml.
- Øvrige indholdsstoffer: polysorbat 20 (E 432), natriumdihydrogenphosphatmonohydrat (til justering af pH), dinatriumhydrogenphosphatheptahydrat (til justering af pH), natriumchlorid, saccharose, vand til injektionsvæsker.
Se ’Eylea indeholder’ i punkt 2 for flere oplysninger.
Udseende og pakningsstørrelser
Eylea er en injektionsvæske, opløsning (injektion) i en fyldt injektionssprøjte. Opløsningen er farveløs til let gul.
Pakningsstørrelse 1 stk. fyldt injektionssprøjte.
Indehaver af markedsføringstilladelsen og fremstiller
Indehaver af markedsføringstilladelsen
Bayer AG
51368 Leverkusen
Tyskland
Fremstiller
Bayer AG
Müllerstraße 178
13353 Berlin
Tyskland
Hvis du ønsker yderligere oplysninger om dette lægemiddel, skal du henvende dig til den lokale repræsentant for indehaveren af markedsføringstilladelsen:
Danmark
Bayer A/S
Tlf: +45-45 235 000
Andre informationskilder
Du kan finde yderligere oplysninger om dette lægemiddel på Det Europæiske Lægemiddelagenturs hjemmeside https://www.ema.europa.eu.
Skan her for at se hjemmesiden med lokal information: https://www.pi.bayer.com/eylea1.
QR-koden med link til indlægssedlen er inkluderet.
Oplysninger tiltænkt læger og sundhedspersonale
Sådan forberedes og administreres Eylea til for tidligt fødte spædbørn
Den fyldte injektionssprøjte må kun anvendes til behandling af et enkelt øje. Optrækning af flere doser fra én fyldt injektionssprøjte kan øge risikoen for kontaminering og efterfølgende infektion.
Det sterile fyldte blisterkort med injektionssprøjte må ikke åbnes uden for det rene rum, hvor administrationen finder sted. Ikke anvendt lægemiddel samt affald heraf skal bortskaffes i henhold til lokale retningslinjer.
Den fyldte injektionssprøjte indeholder mere end den anbefalede dosis på 0,4 mg aflibercept (svarende til 0,01 ml). Til behandling af for tidligt fødte spædbørn skal PICLEO pædiatrisk doseringsudstyr i kombination med den fyldte sprøjte anvendes til administration af en enkeltdosis på 0,4 mg aflibercept (svarende til 0,01 ml). Se følgende punkt "Brugsanvisning til fyldt injektionssprøjte".
Før injektion skal injektionsvæsken inspiceres visuelt for fremmedlegemer, misfarvning eller enhver forandring i det fysiske udseende. Produktet bortskaffes, hvis en af disse observeres.
Den uåbnede blister kan opbevares uden for køleskab ved temperaturer under 25 °C i op til 24 timer. Efter at blisteren er åbnet, fortsættes proceduren under aseptiske betingelser.
Der skal bruges en 30 G x ½"-kanyle til intravitreal injektion.
Brugsanvisning til fyldt injektionssprøjte:
For at forberede den fyldte injektionssprøjte til administration til for tidligt fødte spædbørn skal trin 1 og 2 nedenfor følges, og brugesanvisningen, der medfølger i pakningen med PICLEO pædiatrisk doseringsudstyr skal også følges.
1. Når du er klar til at administrere Eylea, åbner du æsken og fjerner den steriliserede blister. Blisteren åbnes forsigtigt, så indholdet forbliver sterilt. Opbevar injektionssprøjten på den sterile bakke, indtil du er klar til at samle den.
2. Injektionssprøjten fjernes fra den steriliserede blister med aseptisk teknik.
Revisionsdato
Denne indlægsseddel blev senest ændret 06/2025